2006年上期祁阳二中期末考试试卷
高一化学
说明:1、本试卷分第I卷(选择题)和第II卷(非选择题)两部分,卷面总分100分,时间为90分钟。
2、考生将第I卷选择题答案填写在第II卷指定的答案栏内。考试结束只交答题卷。
3、答题前将试卷密封线内的项目填写清楚。
本卷可能用到的原子量:Na:23 、S: 32、H:1、O:16、Mg:24
第Ⅰ卷 (选择题 共51分)
一、选择题(本题包括17小题,每小题3分,共51分。每小题只有一个选项符合题意)
1.北京市获得2008年奥运会的举办权,提出“新北京、新奥运”的口号,并承诺改变北京市环境质量,但经过努力,下列目标还是不可能实现的是
A.拓展绿地,减少扬尘
B.减少丢弃塑料,废旧品进行再利用
C.控制工业废气排放
D.禁止汽车尾气中排放含CO或NO2等气体
2.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是
A.12 B.14 C.16 D.18
3.既有离子键,又有非极性共价键的化合物是
A.MgCl2 B.HBr C.N2 D.Na2O2
4.现在含有元素硒的保健品已开始进入市场.已知硒与氧同族与钾同周期,则下列关于硒的叙述中不正确的是
A.非金属性比溴强 B.最高价氧化物的化学式SeO3
C.原子序数为34 D.气态氢化物的化学式为H2Se
5.下列环保措施主要目的是保护臭氧层的是
A.使用无铅汽油 B.煤气化后提高燃烧效率
C.使用无氟冰箱 D.在燃料煤中添加氧化钙
6.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是
A.HF B.H3O+ C.NaH D.H2O2
7.高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是
A.臭氧和氧气是氧的同素异形体 B.臭氧可使湿润的KI淀粉试纸变蓝
C.臭氧的存在对人体有益无害 D.臭氧是很好的消毒剂和脱色剂
8.下列各组物质的主要成分都为硅酸盐的是
A.石英玻璃 B.人造刚玉 C.地壳和半导体材料 D.陶器和瓷器
9.将下列反应所产生的气体,通入硅酸钠溶液中不发生反应的是
A.二氧化碳与过氧化钠 B.碳酸氢钙受热分解
C.铜与浓硫酸共热 D.浓硫酸与浓盐酸混合
10.下列各项中表达正确的是
![]() A、F-离子的结构示意图:
B、硫原子的一种同位素3216S
A、F-离子的结构示意图:
B、硫原子的一种同位素3216S
![]() C、NaCl的电子式:
D、N2的结构式:
C、NaCl的电子式:
D、N2的结构式:![]()
11.下列变化规律正确的是
A、Cl2、Br2、I2的熔点从高到低 B、HCl、H2S、PH3热稳定性从弱到强
C、Al、Mg、Ca还原性从强到弱 D、H3PO4、H2SO4、HClO4酸性从弱到强
12.发射宇宙飞船的运载火箭的推进剂引燃后,产生的大量高温气体从尾部喷出,该气体的主要成分是CO2、H2O、N2、NO等,在发射现场可看到火箭尾部产生大量红色气体,其原因是
A.高温下N2遇空气生成NO2 B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2 D.NO与H2O反应生成H2和NO2
13.根据元素在周期表中的位置判断,下列说法正确的是
A. 在元素周期表中金属和非金属的交界处可以找到半导体材料
B. Be(OH)2(氢氧化铍)易溶于水
C.Tl(OH)3(氢氧化铊)一定是两性氢氧化物
D.RaCO3(碳酸镭)是易溶于水的盐
14.下列实验方案能达到预定目的的是
A、将SO2通入石蕊溶液中证明SO2有漂白性
B、用绿豆大小的钠和钾分别与冷水反应说明钠、钾金属性的强弱
C、向某未知溶液中加入BaCl2溶液后再加入稀硝酸,检验是否含SO42-
D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
15. 向50mL18mol/LH2SO4溶液中加入足量的铜粉并加热,充分反应后被还原的硫酸的我物质的量:
A、小于0.45mol B、等于0.45mol
C、在0.45mol和0.90mol之间 C、大于0.90mol
16.以NA表示阿伏加德罗常数,下列说法正确的是:
A.常温常压下,11.2L氧气所含的原子数为NA
B.2.3g金属钠变为钠离子时失去的电子数为0.1NA
C.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
D.标准状况下,22.4L水所含分子数为NA
17.已知由NaHS、MgSO4、NaHSO4组成的混合物,硫元素的质量分数为a%,则混合物中氧元素的质量分数为
A.a% B.2a% C.1-1.75a% D.1-0.75a%
第Ⅱ卷 (非选择题 共49分)
二、实验题(本大题共1小题,共10分)
18.(10分)实验室合成SO3的装置如下图所示;试回答:
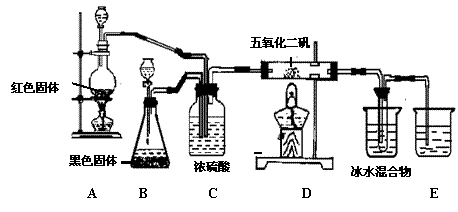 |
(1)装置B中的黑色固体是 ;
(2)装置C的作用: ① ;② ;
(3)D处反应的化学方程式 ;
(4)E中冰水混合物的作用是
三.填空题(本题包括3小题,共18分)
19.(6分)在原子序数为 1 — 18 号的元素中, 用适当的化学符号填写下列空白(稀有气体除外):
(1)原子半径最大的是 _______ , 简单离子中, 离子半径最大的是 _____
(2)气态氢化物最稳定的是 ___ , 气态氢化物中含有H 元素质量分数最大的氢化物是___
(3)酸性最强的含氧酸是 _________,属于两性氢氧化物的物质是___________.
20.(4分)下列分子结构图中的大黑点表示原子序数小于10的元素的“原子实”(指原子除去最外层电子的剩余部分),小黑点表示没形成共价键的最外层电子,短线表示共价键。 示例如下:(4分)


代表的分子是 。
![]() 代表的分子是 。(写化学式)
代表的分子是 。(写化学式)
21.(8分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质/元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | – 218.4 | 113 | 452 | |
| 单质沸点(℃) | – 183 | 444.6 | 685 | 1390 |
| 主要化合价 | – 2 | – 2、+ 4、+ 6 | – 2、+ 4、+ 6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据上表回答下列问题:
(1) 硒的熔点范围可能是______________________;
(2) 碲的化合价可能有__________________;
(3) 硫、硒、碲的氢化物的稳定性由强至弱的顺序是_______________(填化学式)。
(4) 氢硒酸有较强的还原性,因此放在空气中长期保存易变质,其可能发生反应的化学方程式为________________________ 。
 2006年上期祁阳二中期末考试化学试卷答题卷
2006年上期祁阳二中期末考试化学试卷答题卷
第Ⅰ卷答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| 答案 |
二、实验题(本大题共1小题,共10分)
18.(10分)(1) ;
(2)① ,
②
(3) ;
(4)作用 。
三.填空题(本题包括4小题,共15分)
19(6分)(1) ,
(2) ,
(3) ,
20.(4分)
21.(8分)(1)硒的熔点范围可能是______________________;
(2)碲的化合价可能有__________________;
(3)_______________ (填化学式)。
(4)________________________ 。
四.推断题(本题包括2小题,共16分)
22.(8分)短周期四种元素A、B、C、D原子序数依次增大,A元素原子最外
| 座号 |
层电子数为次外层电子数的2倍,C元素原子的次外层电子数为最外层电子数的2倍,C与D可形成共价化合物CD4,B与D可形成离子化合物BD2。
(1)用电子式表示BD2的形成过程:
其中离子半径的大小关系:B D(填“>”、“<”或“=”)
(2)A、C、D三种元素所对应的气态氢化物中,最不稳定的是 (填分子式),最高价氧化物的水化物酸性由强到弱的顺序是(填分子式)
。
23.(8分)在下面所示的转化关系中,已知A、D都为单质,且B、D都为淡黄色固体,A与D可反应生成离子化合物。回答:
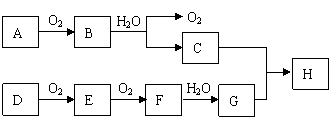 |
(1)写出下列物质的化学式:
A ,F ,H 。
(2)写出化学方程式:
B→C:
五.计算题(本题包括1小题,共5分)
24.(5分)用18.4mol/L的浓硫酸20mL和铜共热一段时间后,使反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,所得SO42—离子的浓度为3.18mol/L,求定容后溶液中CuSO4的物质的量。
2006年上期祁阳二中期末考试化学试卷答案
第Ⅰ卷答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | C | D | A | C | C | C | D | A |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| 答案 | A | D | B | A | B | A | B | C |
二、实验题(本大题共1小题,共10分)
18.(10分)(1) 二氧化锰(MnO2)
(2)① 干燥气体(或除去混合气体的水蒸气),② 观察气体的流速,使SO2与O2以最佳比混合,③ 使气体混合均匀;(任写2个即可)
 |
(3)2SO2+O2 2SO3 (4)使SO3冷却成固体。
三.填空题(本题包括3小题,共18分)
19(6分)(1) Na , Cl-
(2) HF , CH4
(3) HClO4 , Al(OH)3
20.(4分)BF3、F2
21.(8分) (1) 113℃<熔点<452℃;(2分) (2) – 2,+4,+6;(2分)
(3) H2S>H2Se>H2Te(2分) (4) 2H2Se + O2 = 2Se↓+ 2H2O(2分)
![]() 四.推断题(本题包括2小题,共16分)
四.推断题(本题包括2小题,共16分)
22.(8分)(1)
<
(2) SiH4 ; HClO4>H2CO3>H2SiO4
23.(8分)(1)A Na,F SO3,H Na2SO4
(2)B→C:2Na2O2+2H2O==4NaOH+O2↑
五.计算题(本题包括1小题,共5分)
24.解:根据方程式:Cu +2H2SO4(浓) ![]() CuSO4
+SO2↑ +2 H2O
CuSO4
+SO2↑ +2 H2O
n(CuSO4 )=n(SO2)=18.4mol/L×0.02L—3.18mol/L×0.1L=0.05mol......(3分)
C(CuSO4 )=![]() =
=![]() =0.5mol/L................................(2分)
=0.5mol/L................................(2分)