温州市部分中学2004学年第一学期期中联考
高一化学试题卷
本卷可能用到的相对原子质量数据:H-1 C-12 Li-7 O-16 Cl-35.5 Na-23 K-39 Rb-85
一、选择题(本题有28小题,每小题2分,共56分。每小题只有1个选项符合题意,不选、多选、错选均不给分)
1.下列说法正确的是( )
A. 化学反应中的能量变化都表现为热量变化
B. 任何放热反应在常温条件下一定能发生反应
C. 需要加热才能发生的反应一定是吸热反应
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
2.焰色反应是指( )
A. 可燃物在燃烧时其火焰表现出的焰色
B. 是检验各种元素的普遍方法
C.一部分金属及其化合物在无色火焰上灼烧时火焰呈现的特征颜色
D.把一些金属盐的溶液放在火焰上加热
3.电子工业制造光电管时,需要一种经强光照射就失去电子,从而接通电路的材料。制造这种材料的物质应属于( )
A.放射性元素 B.超铀元素 C.卤族元素 D.碱金属元素
4.欲观察燃烧的火焰颜色,燃气导管口的材料最好是( )
A.钠玻璃 B.钾玻璃 C.铜 D.石英玻璃
5.某离子方程式:m M+n H++O2==x M2++y H2O中x的值为( )
A.2 B.4 C.6 D.9
6.下列反应中,属于氧化还原反应,但水既不是氧化剂又不是还原剂的是( )
A.CaO+H2O==Ca(OH)2 B.2Na+2H2O==2NaOH+H2↑
C.Cl2+H2O==HCl+HClO D.2F2+2H2O==4HF+O2
7.对于放热反应 A+B→C+D,以下说法正确的是( )
(EA、EB、EC、ED分别表示A、B、C、D所具有的能量)
A.EA>EC B.EA>EC+EB
C.EA+EB>EC+ED D.EA+EB<EC+ED
8.下列反应属于吸热反应的是( )
A.铝和盐酸反应 B.碳和二氧化碳共热
C.生石灰溶于水 D.天然气燃烧
9.碱金属元素原子的次外层电子数是( )
A.2 B.8 C.2或8 D.2 8或18
10.下列碱金属与水反应生成的碱,其中碱性最强的是( )
A.锂 B.钠 C.钾 D.铷
11.已知煤油的密度是0.8 g/cm3,试根据金属钠的保存方法和钠与水反应的现象,推测金属钠的密度(g/cm3)是( )
A.小于0.8 B.大于1.0 C.0.8~1.0 D.等于0.97
12.下列叙述错误的是( )
A.钠燃烧时发出黄色的火焰 B.钠的空气中燃烧生成过氧化钠
C.钠与硫化合可能发生爆炸 D.钠放入胆矾溶液中会置换出铜
13.①钠比水轻;②钠的熔点较低;③钠的硬度小;④钠与水反应放热;⑤钠与水反应后溶液呈碱性。某学生将一小块钠投入滴有酚酞试液的水中,据此实验能证明上述五点性质中的( )
A.①②③ B.③④⑤ C.①②④⑤ D.①②③④⑤
14.硫与热的烧碱溶液反应的化学方程式为( )
3S+6NaOH==2Na2S+Na2SO3+3H2O。下列有关叙述正确的是
A.S是氧化剂,NaOH是还原剂
B.Na2S是还原产物,H2O是氧化产物
C.氧化剂与还原剂的质量之比为2:1
D.氧化剂与还原剂的质量之比为1:2
15.下列叙述中,错误的是( )
A. 在常温常压下,0.5mol H2的质量是1克
B.35.5克Cl2 变成Cl-时,可接受1 mol 电子
C.常温常压下,活泼金属从盐酸中置换出1 mol H2,转移 2mol 电子
D.质量相等的O2和O3所含有的氧原子个数之比为2:3
16.在标准状况下,A mL某气体的质量是B克,则该气体的相对分子质量是( )
A.22400A/B B.22400B/A C.B/22400A D.A/22400B
17.下列有关过氧化钠的叙述,不正确的是( )
A. 可用作潜水艇中的供氧剂
B. 加入滴有少量酚酞的水中,充分反应,最后溶液显红色
C. 比氧化钠稳定,能在空气中稳定存在
D.与碳酸氢钙溶液反应,既产生气体,又生成沉淀
18.下列微粒半径最大的是( )
A.K B.Na C.Na+ D.Rb
19.1.95克金属钾投入9克水中,反应后溶液中水分子和钾离子物质的量之比为( )
A.18:39 B.10:1 C.90:1 D.9:1
20.某碱金属15.6 g跟水作用时,在标准状况下能生成4.48L氢气。这种元素是( )
A.Li B.Na C.K D.Rb
21.常保存在煤油中的是( )
A.锂 B.钠 C.铁 D.镁
22.下列关于碱金属的描述:①随着原子序数增加,原子半径增大;②碱金属原子最外层有一个电子;③其离子具有稀有气体元素原子的电子层结构;④随着原子序数增加,其单质熔点升高;⑤随着电子层数增加,金属性增强。其中正确的是( )
A.①②⑤ B.①②③⑤ C.③④ D.都正确
23.关于同温同压下同体积的CO2和CO的叙述:①质量相等②密度相等③所含分子数相等④所含碳原子个数相等。其中正确的是( )
A.①②③④ B.②③④ C.③④ D.③
24.若NA表示阿伏加德罗常数的数值,下列说法错误的是( )
A.1 mol H2O所含质子数为10NA
B.0.5mol Al与足量的氢氧化钠溶液反应转移的电子数为1.5NA
C.在标准状况下,0.5NA个氯气分子所占的体积约是11.2L
D.不在标准状况下,22.4LO2含有的分子数一定不是NA
25.由相对原子质量分别为12和1的X、Y两种元素组成某气态化合物在标准状况下0.56L质量为0.75克,则该化合物的化学式为( )
A.XY4 B.XY3 C.X2Y6 D.X2Y2
26.下列溶液中分别加入少量过氧化钠,不会出现浑浊的是( )
A.碳酸氢钙溶液 B.饱和石灰水 C.硝酸银溶液 D.碳酸氢钠溶液
27.要除去碳酸钠固体中混有的碳酸氢钠,最好的办法是( )
A.加入足量稀盐酸 B.加入适量氢氧化钠溶液
C.加热至质量不再减轻 D.通入过量的二氧化碳
28.下列各组离子在溶液中能大量共存的是( )
A.Na+、H+、CO32-、Cl- B.H+、K+、Cl-、NO3-
C.Na+、Al3+、OH-、Cl- D.NH4+、H+、OH-、NO3-
二、填空题(本题有3小题,共20分)
29.写出下列反应的离子反应方程式
(1)锌与盐酸反应:
(2)硫酸钠溶液与氯化钡溶液混合:
(3)盐酸滴在石灰石上:
(4)碳酸氢钠溶液与澄清石灰水混合:
(5)钠与胆矾溶液反应:
30.选择下列关于钠的用途的编号,填入各小题的空格内
A.作核反应堆导热剂 B.冶炼稀有金属
C.用于道路、广场的照明 D.制取过氧化钠
(1)在稀有气体的保护下,钠跟熔融的四氯化钛反应用于 ;
(2)钠和钾的合金用于 ;
(3)钠在空气中燃烧用于 ;
(4)填充高压钠灯用于 。
31.铜加入到硝酸中会发生氧化还原反应,且硝酸浓度不同则还原产物不同,其中有化学方程式为:Cu+4HNO3==Cu(NO3)2+2NOx↑+2H2O的反应,则在该反应中,氧化剂是 ,被还原的元素是 ,氧化产物是 ,x= 。并用双线桥表示电子转移的数目和方向。
三、简答题(本题有2小题,共12分)
32.苏打和小苏打有着广泛应用,试从反应物的消耗量角度说明在下列情况中,A苏打、B小苏打如何使用,并说明原因。
(1)做面条时防止面条因较长时间储存而变酸味,常加入适量的面碱,选用 ,因为 。
(2)选择泡沫灭火器的药品,选用 ,因为 。
(3)洗涤餐具及实验室的玻璃仪器等,选用 ,因为 。
33.在开展研究性学习活动中,某研究小组的同学设计了如下3套实验装置,用来收集和验证铁在高温下与水蒸气反应的气体产物。
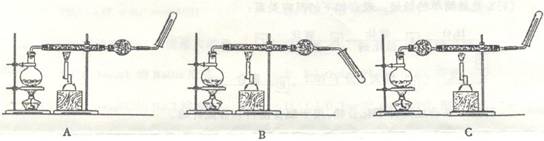 (1)指出能正确得出实验结论的装置(填“A”、“B”或“C”) 。
(1)指出能正确得出实验结论的装置(填“A”、“B”或“C”) 。
(2)写出铁在高温下与水蒸气反应的化学方程式 。
(3)怎样用简单方法检验收集到的气体,简述检验操作的方法和现象 。
四、计算题(本题有2小题,共12分)
34.把一表面已被氧化成白色固体的金属钠0.584克,放入9.436克水中,当反应完毕时,生成标准状况下的氢气0.224L。
计算:(1)此金属钠中有多少克钠跟水反应前已被氧化?
(2)所得溶液的溶质质量分数是多少?
35.加热3.24克碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为2.51克。并将剩余固体与足量的盐酸溶液反应。
计算:(1)原混合物中碳酸钠和碳酸氢钠的物质的量分别是多少?
(2)产生的气体在标准状况下的体积是多少?
 温州市部分中学2004学年第一学期期中联考
温州市部分中学2004学年第一学期期中联考
高一化学答题卷
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | ||||||||||||||
| 题号 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 答案 |
二、填空题(本题有3小题,共20分)
29.(共10分:)
(1)
(2)
(3)
(4)
(5)
30.(共4分)
、 、 、 。
31.(共6分)
、 、 、 。
Cu+4HNO3=Cu(NO3)2+2NOx↑+2H2O
三、简答题(本题有2小题,共12分)
32.(共6分)
(1) 、
(2) 、
33.(共6分)
(1) (2)
(3)
。四、计算题(本题有2小题,共12分)
34.(共6分)
35.(共6分)
温州市部分中学2004学年第一学期期中联考
高一化学参考答案
一、选择题(本题有28小题,每小题2分,共56分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | D | C | D | D | A | C | C | B | C | D | C | D | C | C |
| 题号 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 答案 | D | B | B | D | D | C | B | B | C | D | C | D | C | B |
二、填空题(本题有3小题,共20分)
29.(共10分:2×5=10)
(1)Zn+2H+==Zn2++H2↑
(2)SO42-+Ba2+==BaSO4↓
(3)CaCO3+2H+== Ca2++CO2↑+H2O
(4)HCO3-+OH-+Ca2+== CaCO3↓+H2O
或2HCO3-+2OH-+Ca2+== CaCO3↓+CO32-+2H2O
(5)2Na+2H2O+Cu2+== 2Na++Cu(OH)2↓+H2↑
30.(共4分:1×4=4)
B、A、D、C
31.(共6分:1×4+2=6)
HNO3、 N、 Cu(NO3)2、 2
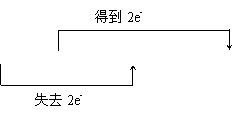 |
Cu+4HNO3=Cu(NO3)2+2NOx↑+2H2O
三、简答题(本题有2小题,共12分)
32.(共6分:1+2+1+2=6)
(1)A 中和等量的酸,碳酸钠比碳酸氢钠的用量少。
(2)B 产生等量的二氧化碳,碳酸氢钠比碳酸钠的用量少。
|
(1)A (2)3Fe+4H2O==== Fe3O4+4H2
(3)用大拇指堵住试管口,慢慢移到酒精灯外焰,松开手指,有轻微的爆鸣声,说明气体产物是H2.
四、计算题(本题有2小题,共12分)
34.(共6分:4+2=6)
(1)此金属钠中有0.092克钠跟水反应前已被氧化
(2)所得溶液的溶质质量分数是9.6%
35.(共6分:3+3=6)
(1)原混合物中碳酸钠和碳酸氢钠的物质的量分别是0.01 mol、0.02mol
(2)产生的气体在标准状况下的体积是0.448L