江苏省白蒲高级中学2005年上学期期中试卷
高一化学试卷
时间:120分钟 分值:100分 命题人:毛娟
原子量:Na—23 O—16 C—12 H—1 N—14 Cl—35.5 P—31 S—32
K—39 Mn—55 Br—80 Cu—64
一、选择题(每小题仅有一个正确答案符合题目要求)
1、下列物质中,不能导电的是
A、熔融的氢氧化钠 B、炭棒
C、盐酸 D、固态氯化钾
2、下列化学反应属于吸热反应的是
A、镁条在氧气中燃烧 B、铝片与盐酸反应
C、氢氧化钡与氯化铵晶体搅拌 D、氢氧化钠与盐酸反应
3、关于强弱电解质的区分正确的是
A、导电性强的是强电解性,导电性弱的是弱电解质
B、易溶物是强电解质,难溶物是弱电解质
C、离子化合物是强电解质,共价化合物是弱电解质
D、在水溶液中,完全电离的是强电解质,部分电离的是弱电解质
4、某化学反应的生成物为两种化合物,该反应肯定不属于
①化合反应 ②分解反应 ③置换反应 ④复分解反应
A、①② B、①③
C、②③ D、②④
5、在呼吸面具中,Na2O2与CO2发生反应时转移的电子数为6.02×1023个,则生成O2的物质的量为
A、0.25 mol B、0.5 mol
C、1 mol D、2 mol
6、在强酸性溶液中可发生如下反应:
![]() 2Mn2++5R2O8x—+8H2O 16H++10RO42—+2MnO4—
2Mn2++5R2O8x—+8H2O 16H++10RO42—+2MnO4—
这个反应可定性地检验Mn2+的存在,在反应中充当氧化剂R2O8x—中R的化合价为
A、0 B、2 C、8 D、7
7、下列变化一般需要加入适当氧化剂才能实现的是
A、Cl2→Cl— B、HNO3→NO2
C、SO2→H2SO3 D、PCl3→PCl5
8、150℃,碳酸铵(NH4)2CO3完全分解生成气态混合物,其密度是相同条件下氢气密度的n倍,n的值是
A、96 B、48 C、24 D、12
二、选择题(每小题有1~2个正确答案符合题意)
9、下列说法正确的是
A、1 mol任何气体的体积一定是22.4 L
B、同温同压下的两种气体,只要它们的分子数相同,所占体积也一定相同
C、1 mol盐酸的质量是36.5 g
D、在标准状况下,体积为22.4 L的物质都是1 mol
10、下列离子方程式中,书写正确的是
A、澄清石灰水中加入足量小苏打:Ca2++2OH—+2HCO3—=CaCO3↓+CO32—+2H2O
B、碳酸钾溶液中加入足量HCl:CO32—+2H+=H2O+CO2↑
C、硫酸铜溶液中加入钠:Cu2++2Na=2Na++Cu
D、硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH—=Cu(OH)2↓
11、下列各组中的离子,能在溶液中大量共存的是
A、H+、Na+、SO42—、CO32— B、OH—、K+、Ba2+、NO3—
C、K+、Cu2+、SO42—、Cl— D、Mg2+、SO42—、Cl—、Ba2+
12、下列反应中,水仅作氧化剂的是
A、钠与水反应 B、过氧化钠与水反应
C、氧化钠与水反应 D、电解水制H2和O2
13、在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和O2的混合气体(不发生反应),在同温同压下,两容器内的气体一定具有相同的
A、质量 B、密度 C、物质的量 D、分子数
14、按照Li、Na、K、Rb、Cs的顺序,下列叙述中错误的是
A、原子半径依次增大 B、单质还原性依次增强
C、单质熔点依次降低 D、单质密度依次减小
15、用NA表示阿伏加德罗常数,下列叙述中,正确的是
A、常温常压下,11.2 L氯气所含的原子数为NA
B、常温常压下,钠与水反应生成1 g氢气转移电子数为NA
C、1.9 g H3O+中含有的电子数为1.1 NA
D、2NA个H2SO4分子与196 g H3PO4分子含有相同的氧原子
16、钡和钠相似,也能形成含有O22—的过氧化物。则下列关于过氧化钠和过氧化钡的说法中正确的是
A、过氧化钡的化学式为Ba2O2
B、在过氧化钠和过氧化钡中氧元素的化合价都是-2价
C、过氧化钡和盐酸反应的离子方程式:O22—+4H+=2H2O
D、在过氧化钡与水所发生的反应中,过氧化钡既作氧化剂又作还原剂
17、估计下列溶液中质量分数最大的是
A、4.6 g Na投入45.4 g水中 B、6.2 g Na2O投入43.8 g水中
C、7.8 g Na2O2投入42.2 g水中 D、8 g NaOH投入42 g水中
18、有五瓶溶液分别是:①10ml 0.60 mol/L NaOH水溶液;②20ml 0.50 mol/L H2SO4水溶液;③30ml 0.40 mol/L HCl水溶液;④40ml 0.30mol/L CH3COOH水溶液;⑤50ml 0.20mol/L蔗糖水溶液。以下各瓶溶液所含离子、分子总数的大小顺序正确的是
A、①>②>③>④>⑤ B、②>①>③>④>⑤
C、②>③>④>①>⑤ D、⑤>④>③>②>①
高一化学答卷
一、选择题(每小题仅有一个正确答案符合题目要求)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
二、选择题(每小题有1~2个正确答案符合题意)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三、填空题
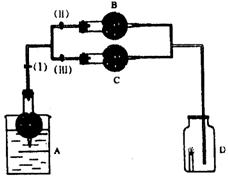 19、在干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体,并将A、B、C按右图所示连接。
19、在干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体,并将A、B、C按右图所示连接。
当打开活塞(I)(II)时,D中蜡烛火焰明亮;打开活塞(I)(III)时,D中蜡烛火焰熄灭;关闭活塞(I)时,A中反应可自行停止。
试根据上述实验现象,回答以下各题:
(1)A中发生的化学反应方程式是_________________________________________。
(2)在装置B中的淡黄色粉末是_________________,发生的化学反应方程式是________________________________________。
(3)在干燥管C中的白色固体应为________________________。
20、(1)含相同分子个数的二氧化碳和一氧化碳,其质量比为___________,摩尔质量比为___________,物质的量之比为__________,同温同压下气体的密度比为___________。
(2)物质的量为1 mol的12C中含有12C的数目是____________,它们的质量是__________kg;含有相同数目的H2的物质的量是___________mol;质量是__________kg。
21、(1)鉴别KHCO3溶液和K2CO3溶液的试剂是______________,离子方程式为_________________________________________________。
(2)除去混合在NaCl溶液中的少量NaHCO3杂质的试剂是_____________,离子方程式为___________________________________________________。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用______________方法,化学方程式___________________________________________________。
22、已知高锰酸钾和氢溴酸发生反应:
2KMnO4+16HBr=2KBr+2MnBr2+5Br2↑+8H2O
(1)反应中的还原剂_________________;
(2)在原题中用双线桥标出电子转移的方向和数目;
(3)若消耗15.8 g氧化剂,则被氧化的还原剂的物质的量是__________mol。
23、某固体混合物可能由KNO3、K2SO4、CaCl2、NaCl、CuCl2、Na2CO3中的一种或几种组成,依次进行如下实验,观察到的实验现象记录如下:
①用干净的铂丝蘸取混合物在酒精灯火焰上灼烧,透过蓝色的钴玻璃,可以观察到火焰呈紫色;
②混合物加水得到无色溶液;
③向上述溶液中滴加过量BaCl2溶液,有白色沉淀生成,将该沉淀滤出,此沉淀可完全溶于稀硝酸;
④向③的滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
据此,可判断混合物中肯定含有_____________________________,不能肯定是否含有_________________________________________________________(均用化学式填写)。
24、今有一含NaHCO3 16.8g的稀溶液(无其它溶质),若向其中加入某给定的物质,可将其转化为只含Na2CO3 21.2g的水溶液。有多种物质均可满足“给定的物质”的条件。请完成下列各小题:
(1)你从课本知识中学到的能够满足给定条件的物质就有4种,
它们是:①___________②__________③__________④__________(填化学式)
(2)在实现上述转化的过程中,溶液中碳(C)元素的质量均___________(填“增加”、“不变”或“减小”)
(3)在(1)中填写的各种物质中,溶液前后质量的变化[△m(aq)]相同的质量是___________和___________(填写化学式)。其相对应的质量变化值[△m(aq)]等于___________。
三、计算题
25、铜粉与稀硝酸间发生如下反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。若有6.4 g铜完全反应,则被还原的硝酸是多少克?反应过程中转移了多少摩电子?
26、将NaHCO3和Na2O2的均匀混合物粉末等分为2份,其中1份与足量稀硫酸反应放出气体2.24 L,将此气体通入另一份混合物中充分反应,气体体积变为2.016 L(均为标准状况),求原混合物中Na2O2与NaHCO3的物质的量之比是多少?
高一化学参考答案
一、选择题(每小题仅有一个正确答案符合题目要求 3×8=24分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | D | B | B | D | D | D |
二、选择题(每小题有1~2个正确答案符合题意 3×10=30分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | AB | BC | A | CD | D | BD | D | C | D |
三、填空题
19、⑴CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
⑵ Na2O2 2Na2O2 + 2CO2 = 2Na2CO3 + O2↑ ⑶无水CaCl2或P2O5
20、⑴11︰7 11︰7 1︰1 11︰7 ⑵6.02×1023 0.012 1 0.002
21、⑴Ca2+ 、Ba2+ Ca2+ + CO32- = CaCO3↓
⑵HCl HCO3- + H+ = CO2 ↑+ H2O
![]() ⑶加热 2NaHCO3 Na2CO3 + CO2
+ H2O
⑶加热 2NaHCO3 Na2CO3 + CO2
+ H2O
 22、 ⑴HBr
22、 ⑴HBr
⑵ 2KMnO4+16HBr=2KBr+2MnBr2+5Br2↑+8H2O
⑶0.5
23、KNO3、Na2CO3 NaCl
24、⑴NaOH Na Na2O Na2O2 ⑵不变 ⑶Na2O Na2O2 6.2g
25、解:n(Cu)=6.4g/64g·mol-1=0.1mol
n(被还原的HNO3)= 0.1mol×(2/3)×63 g·mol-1=4.2g (3分)
n(e-)= n(Cu)×2=0.2 mol (3分)
26、解:2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
气体0.1mol ,变为2.016L/22.4L·mol-1 =0.09 mol,差量0.01 mol
所以,Na2O2过量时,CO2为0.02mol,
即O20.08mol,Na2O20.16mol;n(Na2O2) n(NaHCO3)=8︰1 (3分)
同理,CO2过量时,Na2O2为0.02mol,
即O20.01mol,Na2 HCO30.09mol;n(Na2O2) n(NaHCO3)=2︰9 (3分)