徐州高级中学2005——2006学年度第一学期
高一化学期中考试试卷
可能用到的原子量H:1 O:16 C:12 N:14 S:32 Na:23 Al:24 Ca:40 Cu:64 Ba:137 K:39 Cl:35.5
第I卷(选择题,将答案填写在II卷指定位置)
一、选择题(每小题2分,共10小题,计20分。每小题只有一个选项符合题意)
1. 下列液体分别与碘水混合,充分振荡,静置后上层液体为紫色,下层液体为无色的是
A. 四氯化碳 B. 酒精 C. 苯 D. 氯水
2. 下列有关分散系属于胶体的是
A. 淀粉溶液 B. 食盐水 C. 牛奶 D. 碘酒
3. 已知丙酮是一种有机化合物,为无色液体,不溶于水,密度小于1g/cm3,沸点约为55OC,要从丙酮和水的混合物中将丙酮分离出来,下列方法中最合理的是
A. 蒸馏 B. 分液 C. 过滤 D. 结晶
4. 某原子含有6个电子、7个中子,它的化学符号为
A. 13Al B. 13Al C. 13C D. 13C
5、下列各组物质中,互为同位素的是
A.H2O和T2O B.金刚石和石墨 C.24Mg和26Mg D.O2和O3
6. 相同质量的下列气体中,所含原子数最多的是
A. CH4 B. N2 C. CO D. O2
7. 已知一个O2分子的实际质量为 a g ,则阿伏加德罗常数可表示为
A. a mol—1 B. 32/ a mol—1 C. 32 a mol—1 D. a / 32mol—1
8. 100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3 溶液混合后,溶液中SO42— 物质的量浓度为(两溶液混合时的体积变化可忽略不计)
A. 0.2 mol/L B. 0.25 mol/L
C. 0.40 mol/L D. 0.50 mol/L
9. 容量瓶上需标有
① 温度 ② 浓度 ③ 容量 ④ 压强 ⑤ 刻度线 ⑥ 酸式或碱式
A. ①③⑤ B. ③⑤⑥ C. ①②④ D. ②④⑥
10. 电解饱和食盐水时,如果溶液中滴有酚酞,则先变红的一极连在电源的
A. 负极 B. 正极 C. 同时变红 D. 都不会变红
二、选择题(每小题2分,共10小题,计20分。每小题有一至两个选项符合题意)
11. 下列各组物质均为纯净的化合物的是
A. 石灰水、氨水、二氧化碳 B. 空气、食盐水、乙醇
C. 冰、干冰、乙醇 D. 氨气、氢气、氯化钠
12. 设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 常温常压下,11.2L 氧气所含氧原子数为NA
B. 1.8g 的NH4+ 离子中含有的电子数为NA
C. 常温常压下,48g O3 含有的氧原子数为3NA
D. 2.4g 金属镁变为镁离子时失去的电子数为0.1NA
13. 相同条件下,由H2、N2、CO2等体积混合得到的混合气体中,CO2的质量为Wg,这种混合气体的质量为
A. 37/22 Wg B. 15/22 Wg C. 20/11 Wg D. 74/9 Wg
![]() 14. 某元素R的阴离子R2—核外共有a个电子,核内有b个中子,则表示R原子的符号正确的是
14. 某元素R的阴离子R2—核外共有a个电子,核内有b个中子,则表示R原子的符号正确的是
A. bR B. a+2R C. a+2R D. a—2R
15. 需要加入适当的氧化剂才能实现的反应是
A. PCl3 → PCl5 B. MnO2 → Mn2+
C. SO2 → SO32— D. Fe → Fe3O4
16. 使用胆矾(CuSO4·5H2O)配制1L 0.1 mol/L 的CuSO4溶液,正确的操作是
A. 将胆矾加热除去结晶水后,称取16g 溶解在1L 水中
B. 称取胆矾25g溶解于1L水中
C. 将25 g 胆矾溶于少量水,然后将溶液稀释到1L
D. 将16 g无水硫酸铜溶于水,然后将溶液稀释到1L
17. 某Al2(SO4)3溶液VmL 中含a g Al3+,取出V/4 mL 溶液稀释成 4VmL后,溶液中SO42— 的物质的量浓度为
A. 125a / 54 mol/L B. 125 a / 36V mol/L
C. 125 a / 18V mol/L D. 125 a / V mol/L
18. 氯气是有毒的,曾被法西斯制成毒气弹用于侵略战争。当这种毒气弹顺风爆炸时,通常可用的防御方法是
A. 人畜应躲到低洼的地方 B. 人畜应躲到较高的地方去
C. 人畜应多饮豆浆和牛乳 D. 可用肥皂水浸湿软布蒙面
19. 下列两种气体的分子数一定相等的是
A. 质量相等、密度不等的N2和C2H4
B. 等体积、等密度的CO和C2H4
C. 等温、等体积的O2和N2
D. 等压、等体积的N2 和CO2
20. 标准状况下,2.24L NOx气体的质量为4.6g,则x 的值为
A. 1 B. 2 C. 3 D. 4
 徐州高级中学2005——2006学年度第一学期
徐州高级中学2005——2006学年度第一学期
高一化学期中考试试卷答卷纸
第I卷(选择题)
一、选择题(每小题2分,共10题,计20分。每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二、选择题(每小题2分,共10题,计20分。每小题有一至两个选项符合题意)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
第II卷(非选择题)
三、(本题包括2小题,共计19分)
21. (5分)用化学式填空:由H、O、C、Na组成的常见化合物中,属于酸性氧化物的是 ,属于无机含氧酸的是 ,属于碱的是 ,属于有机物的是 (写两种);
(10分)已知反应 ① SO3 + H2O = H2SO4 ② Cl2 + H2O = HCl + HClO
③ 2F2 + 2H2O = 4HF + O2 ④2Na + 2H2O = 2NaOH + H2↑
⑤ 2Na2O2 + 2H2O = 4NaOH + O2↑ ⑥ SiO2 + 2NaOH = Na2SiO3 + H2O
(1)上述反应中属于置换反应的是 (填写序号,下同)
(2)上述反应中不属于氧化还原反应的是 ,H2O 作氧化剂的是 ,H2O 作还原剂的是 ,属于氧化还原反应,但其中H2O 既不作氧化剂也不做还原剂的是 。
(3)标出方程式 ③ 中电子转移的方向和数目
22. (4分)相同质量的SO2和SO3,所含氧原子的个数比为 , 含硫元素的质量比为 ,含氧元素的质量比为 ,含分子数之比为 。
四、(本题包括2小题,共计13分)
23. (7分)某同学按下列步骤配制500mL 0.200mol/L KCl 溶液:
①将烧杯中的溶液转移至500mL 容量瓶中 ② 称量KCl 固体 ③ 向容量瓶中加蒸馏水至刻度线 ④ 计算所需KCl的质量 ⑤ 将KCl加入100 mL 烧杯中,并加适量水
(1)需要KCl 的质量为 。
(2)实验的先后顺序应为 (填写序号)
(3)在 ① 实验中,为防止溶液溅出,应采取的措施是 ,若不慎有溶液溅出,将致使所配溶液的物质的量浓度 。
(4)在进行 ③ 的实验操作时应注意的问题是 ,若加蒸馏水时不慎超过了刻度,会使所配溶液的物质的量浓度 。
(5)在进行 ⑤ 时,为了加快溶解速率,可以采取的措施有
。
24. (6分)现有三瓶失去标签的溶液,分别为NH4Cl、(NH4)2SO4、K2SO4,请设计实验方案将它们区别开来。
| 实验步骤 | 实验现象 | 结论 |
|
|
五、(本题包括2小题,共计14分)
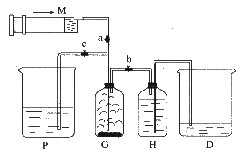 25.
(8分)某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
25.
(8分)某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
(1)装置H中盛放的试剂是 。
(2)尾气处理时,关闭弹簧夹a 和弹簧夹 ,打开弹簧夹 。
(3)处理尾气时,发生反应的化学方程式
是 。
(4)用含0.032mol HCl 的浓盐酸跟足量高锰酸钾固体反应,产生氯气的物质的量应 (填“大于”、“等于”或“小于” )0.01mol。
(5)工业上用电解饱和食盐水的方法可以制得氯气和氢氧化钠,故又称氯碱工业。试写出该反应的化学方程式 。
26. (6分)有一种含有碎菜叶、碎塑料薄膜、泥沙、氯化钠、碳酸钠,还具有一定臭味的生活污水(生活污水的成分十分复杂,此处为了便于讨论,已将其组成作了“简化”),将其经去渣、去臭处理后可转化为厕所的清洁用水。问:
(1)采用何种操作可除去污水中的碎菜叶、碎塑料薄膜和泥沙?
(2)可以用什么物质除去污水中的臭味?
(3)怎样检验(1)和(2)处理后的水里存在的阴离子?(提示:Ag2CO3是一种不溶物,若方法不当,会对实验产生干扰)
六、(本题包括2小题,共计14分)
27. (8分)实验室中需要11.2L(标准状况)二氧化碳,现用含碳酸钙90.0%的石灰石与足量的稀盐酸反应(该石灰石中的杂质不与稀盐酸反应)。问:
(1)至少需要含碳酸钙90.0%的石灰石多少克?
(2)生成氯化钙的物质的量是多少?
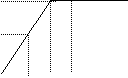
28. (6分)将Ba(OH)2溶液慢慢滴入50mL 0.4mol/L 的H2SO4 溶液中,所得沉淀的质量m与碱溶液的体积V的关系如图所示(溶液的体积变化忽略不计)
|
|
|
|
|
|
|
|
|
(3)求C点时OH—的物质的量浓度
七、附加题(10分)
(NH4)2Cr2O7 是一种受热易分解的盐,下列各组对(NH4)2Cr2O7受热分解产物的判断符合实际的是( )
A. CrO3 + NH3 + H2 B. Cr2O3 + NH3 + H2O
C. CrO3 + N2 + H2O D. Cr2O3 + N2 + H2O
请简述理由
参考答卷
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | A | B | D | C | A | B | C | A | A |
二、选择题
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | BC | A | D | AD | CD | B | BD | AB | B |
三、
21.CO2或H2O2、H2CO2、NaOH、CH4或C2H4、CH2O、C2H5OH等;
③④、①⑥、④、③、②⑤;电子转移方向和数目略
22.5:6、5:4、5:4、5:4
23.7.45g;④②⑤①③;用玻璃棒引流、偏低;离刻度线1~2厘米处改用胶头滴管加水、偏低;研细、搅拌。
24.
| 实验步骤 | 实验现象 | 结论 |
| 取三种试液样品分别滴加Ba(OH)2溶液 | 若只有白色沉淀; 若只有气体产生; 若既有白色沉淀又有气体产生; | 原试剂为硫酸钾溶液 原试剂为氯化铵溶液 原试剂为硫酸铵溶液 |
25.饱和食盐水;b、c;Cl2+NaOH=NaCl+NaClO+H2O;小于;
26.过滤;用木炭吸附;取样品加入过量的稀硝酸,将产生的气体导入澄清的石灰水,若石灰水变浑浊,证明含有碳酸根离子;再继续加入少量的硝酸银溶液,若有白色沉淀生成,证明含有氯离子。
27.55.5g、0.5mol
28.1mol/L、O、0.25mol/L
附加题:D,氧化还原反应中化合价有升必有降或电子有得必有失.