徐州市2005-2006学年高一化学期末测试
模拟试题(新课标)
学校 班级 姓名 学号
总分100分
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 K:39 Fe:56 Zn:65 Ba:137
一、选择题(本题包括8小题,每小题2分,共16分,每小题只有一个正确答案)
1.有同学将NaOH固体、P2O5固体、无水CaCl2固体划分为一类。据此分类,下列A~D选项中能与这三种物质归为一类的是
A.浓硫酸 B.CaO C.碱石灰 D.NaCl
2.2005年3月29日晚,京沪高速公路上发生特大交通事故,一辆装载近35吨液氯的槽车因爆胎与迎面大客车相撞大量液氯外泄,导致多人死伤。下列有关现场处置方法不正确的是
A.将槽罐吊入盛烧碱的临时水池中 B.将人、畜迅速转移到地势较高的地方
C.用毛巾浸透NaOH溶液捂住鼻子 D.用毛巾浸透肥皂水或苏打溶液捂住鼻子
3.科学界最近发现两种粒子。第一种只由四个中子构成,被称为“四中子”,也有人称“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法中,不正确的是
A.“四中子”不显电性 B.“四中子”的质量数为4
C.第二种粒子是氧元素的另一种同位素 D.第二种粒子的化学式为O4
4.质子数和中子数均相等的原子A,其离子An-核外共有x个电子,则A的质量数等于
A.2(x+n) B.2(x-n) C.2x D.2x+n
5.用98%、密度为1.84 g/cm3的浓H2SO4配制l mol/L的稀硫酸100 mL,现给出下列可能用到仪器:①100 mL量筒;②10 mL量筒;③50 mL烧杯;④托盘天平;⑤100 mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用仪器先后顺序排列正确的是
A.②③⑦⑤⑥ B.②⑤⑦⑥ C.①③⑤⑦④⑥ D.④③⑦⑤⑥
6.既能与盐酸反应,又能与NaOH溶液反应的是
①Na2SiO3;②Al(OH)3;③NH4HCO3;④Al2O3;⑤NaHSO4
A.①②④ B.②④⑤ C.②③④ D.全部
7.最新的研究表明:一氧化氮吸入治疗法可快速改善SARS中重症患者的缺氧状况,缓解病情。病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用。下列关于一氧化氮的叙述正确的是
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.含等质量氧元素的一氧化氮与一氧化碳的物质的量相等
D.一氧化氮易溶于水,不能用排水法收集
8.银耳本身为淡黄色,福建省生产的一种雪耳,颜色洁白如雪。其制作过程如下:将银耳堆放在密闭状态良好的塑料棚内,在棚的一端支一口小锅,锅内放有硫磺,加热使硫磺融化并燃烧,两天左右,雪耳就制成了,雪耳炖而不烂,且对人体有害,制作雪耳利用的就是
A.硫的还原性 B.硫的漂白性
C.二氧化硫的还原性 D.二氧化硫的漂白性
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一至两个正确答案)
9.某学生用一定物质的量浓度的稀硫酸和氧化铜进行反应,实验结果如下:
| 实验次数 | m(CuO)/g | 硫酸溶液/(mL) | m(CuSO4)/g |
| ① | 2.0 | 120 | 4.0 |
| ② | 4.0 | 120 | 8.0 |
| ③ | 6.0 | 120 | 9.6 |
| ④ | 8.0 | 200 | 16.0 |
由上表数据可知稀硫酸和氧化铜恰好完全反应的是第几次实验
A.① B.② C.③ D.④
10.不用其他试剂无法鉴别的一组溶液是
A.氯化铁溶液和氯化铜溶液 B.硫酸钠溶液和氯化钠溶液
C.氯化铝溶液和氢氧化钠溶液 D.硫酸氢钠溶液和碳酸钠溶液
11.下列反应的离子方程式正确的是
A.铝片踉氢氧化钠溶液反应:Al+2OH-==AlO2-+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+==BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH==Ca2++2CH3COO-+H2O+CO2↑
D.氯化铝中加入过量的氢氧化钠:Al3++3OH-==Al(OH)3↓
12.将铜粉放入稀硫酸中,加热无明显现象发生。但加入某盐后,发现铜粉质量逐渐减少,则该盐可能是
A.Fe2(SO4)3 B.ZnSO4 C.KNO3 D.NaCl
13.对于某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+),分别进行如下实验:
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。
对于下列离子不能确定其在原溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
14.等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1︰2︰3,则三种硫酸盐溶液的物质的量浓度比为
A.1︰2︰3 B.1︰6︰9 C.1︰3︰3 D.1︰3︰6
 15.用右图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
15.用右图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
| 气体 | a | b | C | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | 铜片 | 酸性高锰酸钾溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3粉末 | 浓硫酸 |
16.已知氮的氧化物踉NaOH溶液发生的化学反应如下:
3NO2+2NaOH==2NaNO3+NO↑+H2O; NO2+NO+2NaOH==2NaNO2+H2O;
现有m mol NO2和n mol NO组成的混合气体,要用NaOH溶液使其完全吸收无气体剩余,现有浓度为a mol/L的NaOH溶液,则需此NaOH溶液的体积为
A.![]() L B.
L B.![]() L C.
L C.![]() L D.
L D.![]() L
L
17.纯碱和小苏打是厨房中两种常见用品,它们都是白色固体,下列区分它们的说法正确的是
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,使火焰颜色发生明显变化的是小苏打
C.用两只小玻璃杯,分别加入少量的两种样品,再加入等浓度的食醋,产生气泡速率较快的是小苏打
D.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打
18.将22.4 g铁粉逐渐加入到含HNO3 0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是

三、本题包括2小题,共21分
19.(14分)某化学兴趣小组在学习分散系时,对氢氧化铁胶体产生了兴趣:为什么氯化铁溶液和氢氧化钠混合会产生氢氧化铁沉淀,而把氯化铁溶液逐滴加到沸水中却得到的是氢氧化铁胶体且外观上和溶液没有区别?胶体分散质粒子直径比浊液分散质粒子直径要小,同样是氢氧化铁,为什么胶体中不能聚集成更大的粒子而沉淀呢?
带着疑问,兴趣小组进行了探究实验:
(1)Ⅰ组用普通滤纸分别对氢氧化铁浊液和氢氧化铁胶体进行了过滤实验,结果发现浊液过滤器的滤纸上留有红棕色固体,而胶体过滤器的滤纸上没有固体留下。由此,Ⅰ组同学得出结论:__________________________________________________________。
(2)Ⅱ组取氢氧化铁胶体于烧杯中,插上电极,接通直流电源,想试验看胶体是否和电解质溶液一样具有导电性。结果却意外的发现,氢氧化铁胶体的红褐色在接电源负极一极明显加深,而另一极却明显变浅了。由此Ⅱ组同学得出初步结论:氢氧化铁胶体粒子可能是带______粒子且带的是______________。进一步得出结论:正是由于这个原因产生的_______作用而使氢氧化铁胶体不容易聚集而沉淀。
(3)辅导老师根据Ⅱ组得出的结论,又做了一个实验:往氢氧化铁胶体中逐滴滴加一种溶液,结果开始时产生沉淀,继续滴加时沉淀又溶解。老师滴加的溶液是______(填序号)
A.2 mol/L H2SO4溶液 B.2 mol/L NaOH溶液 C.2 mol/L MgSO4溶液 D.硅酸胶体
先产生沉淀的原因可能是__________________________________________________,请写出沉淀溶解的离子方程式______________________________________________。
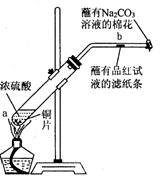 20.(10分)在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。回答下列问题:
20.(10分)在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。回答下列问题:
(1)写出a处反应的化学方程式,并标明电子转移的方向和数目______________________________________。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为_________________________。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为_______________。
(3)待试管中的液体冷却后,将试管上层液体倒去,再慢慢加入少量水,可观察溶液呈_____色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是____________________________,反应的方程式___________________________________。
(5)如果浓硫酸的浓度为18 mol/L,铜片是过量的,加热使之反应,当被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填写“大于”、“等于”、或“小于”)100 mL。
四、本题包括2小题,共12分)
21.(4分)一种无机高分子混凝剂可用于净水,它的化学式可表示为 [Al2(OH)nClm·YH2O],若式中的m用含n的式子表示,则m=______,确定此关系式的依据是 _____。
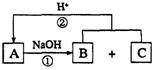 22.(8分)在右图所示的转化关系中,A、B、C是中学化学中常见的物质,都含有同一种元素R,且所含元素的核电荷数均小于18。回答下列问题。
22.(8分)在右图所示的转化关系中,A、B、C是中学化学中常见的物质,都含有同一种元素R,且所含元素的核电荷数均小于18。回答下列问题。
(说明:图中不含R的产物均已略去,反应②的产物之一是A)
(1)若A为一黄绿色的气体单质,则A为_______________。写出A与水反应的离子方程式:_________________________________________。
(2)若A为气态酸性氧化物,A与NaOH溶液反应有三种情况(只生成B、只生成C、同 时生成B和C),则A的化学式为__________________________。写出由A转化只生成B以及由A转化只生成C的离子方程式_____________________________________________, __________________________________________________________________________。
五、本题2小题,共18分
23.(6分)将FeSO4·a (NH4)2SO4·bH2O晶体9.6 g与过量氯化钡溶液反应,生成11.417 g BaSO4;然后加入足量浓NaOH溶液并加热,产生的氨气用100 mL 1mol/L盐酸吸收,剩余的盐酸再用2 mol/L NaOH溶液中和,需NaOH溶液25.5 mL。则
(1)9.6 g晶体中SO42-离子的物质的量是____________。
(2)晶体化学式中a、b的值是(均取整数):a=________;b=________。
24.(12分)用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液500 mL,每次实验均充分反应。实验记录如下:
| 实验次数 | 样品质量/g | 沉淀质量/g |
| 1 | 1.716 | 2.758 |
| 2 | 2.574 | |
| 3 | 3.432 | 5.516 |
| 4 | 4.290 | 5.516 |
回答下列问题:
(1)第2次实验中产生沉淀质量是多少,将结果填入表格空白处。
(2)Ba(OH)2溶液中溶质的物质的量浓度是 。
(3)第2次实验样品中NaHCO3的物质的量是 。
模拟试题 答案
一、选择题(本题包括8小题,每小题2分,共16分,每小题只有一个正确答案)
1. B 2.C 3.C 4.B 5.A 6.C 7.C 8.D
二、选择题(本题包括10小题,每小题3分,共30分,每小题有一至两个正确答案)
9.D 10. B 11.C 12.AC 13.B 14.B 15.D 16.C 17.C 18.C
三、本题包括两小题,共24分:
19.(14分) (1)胶体分散质粒子直径比浊液分散质粒子直径要小
(2)电 同种电荷(正电荷) 电性排斥
(3)A 硫酸电离产生的阴离子(SO42-)中和了氢氧化铁胶体粒子所带的正电荷,从而使氢氧化铁胶体聚集而沉淀 Fe(OH)3+3H+==Fe3++3H2O (各2分)
20.(10分)(1)
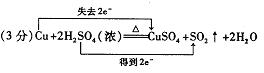
(2)品红褪色 滤纸变红 (3)蓝色
(4)吸收二氧化硫,防止污染 Na2CO3+SO2==Na2SO3+CO2↑(方程式2分,其他各1分)
四、本题两小题,共12分:
21.(4分,每空2分) 6—n 化合物中各元素或原子团的化合价代数和为零
 22. (8分)(1)Cl2(1分)
22. (8分)(1)Cl2(1分)![]() (2分)
(2分)
五、本题两小题,共18分:
23.(1)n(SO42-)=11.417 g÷233 g/mol=0.049 mol(2分)
(2)n(NH4+)=0.01 mol-0.0255 L×2 mol/L=0.049 mol,由此推出(1+a)=2a,a=1;(2分)
晶体的摩尔质量=9.6 g÷0.0245 mol=392 g/mol b=(392-152-132)÷18=6(2分)
24.(1)4.137(4分) (2)0.056 mol/L(4分) (3)0.006 mol(4分)