2004-2005学年度下学期
普宁市中学高一化学期末测试题
可能用到相对原子质量:H:1 C:12 O:16 Na:23 Si:28 S:32 Fe:56 Cu:64 Zn:65
一、选择题:(每题只有一个正确答案,每题3分,共54分)
1、2004年4月22日是第35个“世界地球日”,我国确定的主题是:“善待地球——科学发展”,下列行为不符合这一主题的是 ( )
A、采“绿色化学”工艺,使原料尽可能转化为所需物质
B、大量开采地下水,以满足社会对水的需求
C、减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D、节约能源,提高能源利用率
2、光纤通信是一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信用的光学纤维是下列哪种物质经特殊工艺制成的 ( )
A、石墨 B、石英 C、锗 D、硅
3、下列物质中,在化学实验时可用于提供100℃—200℃热浴的是 ( )
A、水 B、酒精 C、浓硫酸 D、浓盐酸
4。下列化学用语正确是
A.Cl—的示意图 B.OH—的电子式 C.NH4+的结构式 D.HClO的电子式

![]()
![]()
![]()
5、X、Y+、Z-三种微粒的电子层结构相同,则一定不能再相等的是 ( )
A、中子数 B、质量数 C、电子数 D、核电荷数
6、下列各组物质及粒子性质变化正确的是 ( )
A、酸性:HClO4>H2SO4>H2CO3>H3PO4 B、稳定性:H2S>HCl>HBr>HI
C、粒子半径:Br->K+>S2->S D、还原性:S2->Br->Cl->F-
7、能正确表示下列反应的离子方程式是 ( )
![]() A、小苏打溶液与醋酸反应:HCO
A、小苏打溶液与醋酸反应:HCO![]() +H+ CO2↑H2O
+H+ CO2↑H2O
![]() B、过量的CO2使澄清的石灰水最终仍保持澄清:OH-+CO2 HCO
B、过量的CO2使澄清的石灰水最终仍保持澄清:OH-+CO2 HCO![]()
![]() C、碳酸氢钙溶液中加入过量的烧碱溶液:Ca2++HCO
C、碳酸氢钙溶液中加入过量的烧碱溶液:Ca2++HCO![]() +OH- CaCO3↓+H2O
+OH- CaCO3↓+H2O
![]() D、硫化亚铁与稀硝酸反应:FeS+2H+ Fe2++H2S↑
D、硫化亚铁与稀硝酸反应:FeS+2H+ Fe2++H2S↑
8、将0.1mol铁粉和0.06mol硫粉均匀混合后,铺在石棉网上加热,完全反应后,将残渣全部放入过量稀硫酸中充分反应,结果所产生的气体体积在标准状况下明显少于2.24L,其主要原因是 ( )
A、部分铁被空气中的氧气所氧化 B、铁未完全反应
C、硫燃烧变成了SO2 D、铁与硫反应
9、向已呈红色的某酚酞溶液中通入适量的SO2,结果红色消失,其原因是 ( )
A、SO2 具有漂白性 B、SO2 具有还原性
C、SO2 具有氧化性 D、SO2的水溶液呈酸性
10、将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体仍无沉淀生成,则通入的气体可能是 ( )
A、CO2 B、NH3 C、Cl2 D、H2S
11、已知98%的浓H2SO4的浓度为18.4mol·L-1,则49%的硫酸溶液的浓度为 ( )
A、9.2 mol·L-1 B、大于9.2 mol·L-1
C、小于9.2 mol·L-1 D、不能确定
12、目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述不正确的是 ( )
A、该反应为置换反应 B、该球形分子含有极性键和非极性键
C、该物质是一种新化合物 D、该物质的相对分子质量为2400
13、在氧气中灼烧0.485g某金属硫化物,使硫全部转化为SO2,SO2再转化为硫酸、这些硫酸可用20mL0.5mol/L的NaOH溶液完全中和,则原硫化物是 ( )
A、FeS2 B、ZnS C、FeS D、Cu2S
14、某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸沉淀不溶解也无气体逸出,则这种溶液中 ( )
A、一定含有SO![]() B、一定含有Ag+
B、一定含有Ag+
C、一定含有SO![]() 或SO
或SO![]() 或Ag+ D、可能含有SO
或Ag+ D、可能含有SO![]() 或Ag+
或Ag+
15、Al2O3·2SiO2·2H2O是一种
A、混合物 B、硅酸盐 C、铝酸盐 D、两种氧化物的水化物
16、下列说法不正确的有 ( )
A、硅酸盐工业使用的每一种原料中都必须含有硅
B、水泥、普通玻璃都是混合物
C、生产水泥、玻璃和炼铁都需用石灰石
D、用纯净的石英可制成石英玻璃,它的膨胀系数小,常用来制造耐高温的化学仪器。
17、在一定温度下,向55.3g蒸馏水中加入一定质量的无水Na2SO3粉末,充分搅拌后过滤,得到60g滤液和一定质量的Na2SO3·7H2O晶体。若此温度下Na2SO3的溶解度为20g,那么析出的Na2SO3·7H2O晶体的质量是 ( )
A、15.3g B、10.6g C、10g D、5.3g
18、某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种。(1)在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;(2)向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;(3)橙黄色溶液不能使淀粉溶液变蓝。根据上述实验事实推断在该溶液中肯定都存在的离子组是 ( )
A、Na+、Br-、CO32- B、Na+、SO32-、I-
C、Fe2+、I-、SO32- D、Fe2+、CO32-、Br-
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
二、填空题(共46分)
19、(5分)元素的种类决定于 ,元素是否有同位素取决于 ,元素的化学性质主要决定于 ,在原子序数1-18号的元素中酸性最强的含氧酸是(填化学式,下同) ,最稳定的气态氢化物是 。
20、(11分)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38,Y元素原子最外层电子数占核外电子总数的![]() ;W元素原子最外层电子比同周期Z元素多5个电子,W和Y不属于同一主族。
;W元素原子最外层电子比同周期Z元素多5个电子,W和Y不属于同一主族。
(1)写出元素符号:X ,Y ,Z ,W ;
(2)Z、W两种元素最高价氧化物对应水化物反应的方程式是
。
21、(6分)古希腊流传这样一个传奇故事:一批贩运纯碱的商船停泊在江边的沙岸上,商人们找不到石头来搭灶煮饭,就把船上的大块纯碱搬来,放在沙地上垫锅做饭,饭熟后商人们惊奇地发现“灶”变成了晶莹透明的固体,这种固体成分为 ,其主要反应的化学方程式为
22(12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应都用如下图所示的实验装置进行实验,通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
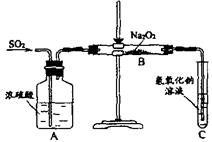
试回答下列问题:
(1)第1小组同学认为反应生成了Na2SO3和O2,该反应的化学方程式为
(2)请设计一种实验方案证明Na2O2和SO2反应生成的白色固体中含Na2SO3。
(3)第2小组同学认为Na2O2和SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下方案
|
| ||||||||
| |||||||||
| |||||||||
![]()
|
上述方案是否合理: 请简要说明理由
①
②
23、(12分) 由短周期元素组成单质A、B、C和甲、乙、丙、丁四种化合物有如图所示转化关系,且已知C为密度最小的气体,甲为非电解质。
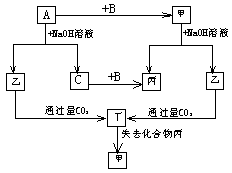
根据以上转化关系回答下列问题:
(1)单质A只可能是 ,因为: 。
(2)写出下列反应方程式:
a: A与NaOH溶液反应:
b: 乙与过量的CO2反应:
三、计算题(10分)
24、将铜片加入115ml某浓H2SO4中,在加热的条件下,铜溶解完全。将所得溶液稀释到500ml,再加入足量的锌粉,使之充分反应,收集到2.24L(标准状况下)气体,过滤得残留固体,干燥称重,质量比加入的锌减轻了7.5g,求原H2SO4的物质的量浓度。
2004-2005学年度下学期
普宁市中学高一化学期末测试题答案
一、选择题(每题3分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | B | C | B | D | D | B | A | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | C | A | B | D | B | A | B | A |
二、填空题
19、(每空1分) 核电荷数(质子数) 中子数 最外层电子数 HClO4 HF
20、(1)(每空2分) X:H Y:O Z:Mg W:Cl
(2)(3分) Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O
21、(每空3分) Na2SiO3和SiO2,
Na2CO3+SiO2
![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
22、(1)(3分) 2Na2O2+2SO2=2Na2SO3+O2
(2)(3分) 取反应后的固体配成溶液,滴加稀盐酸看能否产生使湿润品红试纸褪色的气体。
(3)(每空2分) 不合理
①HNO3氧化性强,会把Na2SO3氧化为Na2SO4。
②溶于水时,若Na2O2剩余,也能把Na2SO3氧化为Na2SO4。
23、(每空3分)
(1) 硅。 与NaOH溶液反应产H2的有Al和Si,而Al2O3为电解质,SiO2为非电解质。
(2)a: Si+2NaOH+H2O=Na2SiO3+2H2↑
(或Si+2NaOH+4H2O=Na2SiO3+2H2↑+3H2O)
b: Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
(或Na2SiO3+2CO2+3H2O=2NaHCO3+H4SiO4↓)
24、解:n(H2)=![]() =0.1mol,所以
=0.1mol,所以
Zn + H2SO4 = ZnSO4 + H2↑
0.1mol 0.1mol 0.1mol
则如下反应使固体质量减轻7.5g-0.1×65g=1g …………………………3分
Zn + CuSO4 = ZnSO4 + Cu △m
65g 1mol 64g 1g
1mol 1g …………………………6分
而Cu + 2H2SO4 = CuSO4+SO2↑+H2O
2mol 1mol
n(H2SO4)=2mol + 0.1mol =2.1mol ……………………………………9分
C(H2SO4)=![]() =
=![]() =18.3mol/L …………………………………10分
=18.3mol/L …………………………………10分