黄山市2005-2006学年度第一学期期末考试
高一化学试题
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共100分。
可能用到的相对原子质量:H 1 O 16 Na 23 P 31 S 32 Cl 35.5
第I卷(选择题,共46分)
一、 选择题(每小题只有一个答案符合题意,每小题2分,共46分)
1.下列情况可能引起大气污染的是①煤的燃烧;②工业废气的任意排放;③燃放鞭炮;④飞机、汽车尾气的排放
A.只有①② B.只有②④ C.只有①②③ D. ①②③④
2.下列容易导电的物质属于强电解质的是
A.熔融的氯化钠 B.铜 C.硫酸溶液 D.无水乙醇
3.少量下列化学药品应用水液封保存的是
A.金属钾 B.碘 C.液溴 D.过氧化钠
4.2004年4月22日是第35个“世界地球日”,我国确定的主题是“善待地球——科学发展”。下列行为中不符合这一主题的是
A.采用“绿色化学”工艺,使原料尽可能转化为所制取的物质
B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的含氟氯化合物
D.节约能源,提高能源利用率
5.2004年4月15日晚19时重庆天原化工总厂发生氯气泄漏事件,消防人员采用消防用水与碱液在外围50米处形成两道水幕进行稀释,稀释后的水进入了天原化工总厂的下水道,有全面的消毒措施。下列适用于消毒的碱是
A.浓氨水 B.![]() 溶液 C.
溶液 C. ![]() D.
D. ![]()
6.下列说法正确的是
A.漂白粉的有效成分是次氯酸钠 B.氟化氢在空气中呈现白雾,这种白雾无毒
C.碘化钾的水溶液能使淀粉变蓝 D.氟气通入水中有氧气生成
7.下列说法中不正确的是
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.在同温同压时,相同体积的任何气体单质所含的分子数目相同
C.在常温常压下,1![]() 氦气含有的原子数数目为6.02×1023
氦气含有的原子数数目为6.02×1023
D. 0.5![]() 一氧化碳分子所占体积是11.2
一氧化碳分子所占体积是11.2![]()
8.下列说法中不正确的是
A.碱金属元素单质的密度随着核电荷数的增加逐渐增大
B.卤化氢的还原性随着核电荷数的增加逐渐增强
C.卤族元素阴离子半径随着核电荷数的增加逐渐增大
D.卤素单质的熔点和沸点随着核电荷数的增加逐渐升高
9.下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应![]()
B.钠与水的反应![]()
C.铜片插入硝酸银溶液中![]()
D.大理石溶于醋酸的反应![]()
10.已知在酸性溶液中,下列物质氧化![]() 时,自身发生如下变化:
时,自身发生如下变化:
![]() ;
;![]() ;
;![]() ;
;![]() 。
。
如果分别用等物质的量的这些物质氧化足量的![]() ,得到
,得到![]() 最多的是
最多的是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
11.在两个容积相同的容器中,一个盛有![]() 气体,另一个盛有
气体,另一个盛有![]() 和
和![]() 的混合气体。在同温同压下,两容器内的气体一定具有相同的
的混合气体。在同温同压下,两容器内的气体一定具有相同的
A.原子数 B.密度 C.质量 D.质子数
12.依照阿佛加德罗定律,下列叙述正确的是
A.同温同压下两种气体的体积之比等于摩尔质量之比
B.同温同压下两种气体的物质的量之比等于密度之比
C.同温同压下两种气体的摩尔质量之比等于密度之比
D.同温同体积下两种气体的摩尔质量之比等于压强之比
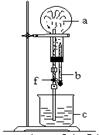 13.在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入 烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯c中的液体呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
13.在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入 烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯c中的液体呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
| a(干燥气体) | b(液体) | |
| A. |
| 水 |
| B. |
| 水 |
| C. |
| 水 |
| D. |
| 饱和食盐水 |
14.根据反应式:(1) ![]()
(2) ![]()
可判断离子的还原性从强到弱的顺序是
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]()
15.下列各组离子
(1)![]() 、
、![]() 、
、![]() 、
、![]() (2)
(2)![]() 、
、![]() 、
、![]() 、
、![]()
(3)![]() 、
、![]() 、
、![]() 、
、![]() (4)
(4)![]() 、
、![]() 、
、![]() 、
、![]()
(5)![]() 、
、![]() 、
、![]() 、
、![]() (6)
(6)![]() 、
、![]() 、
、![]() 、
、![]()
在水溶液中能大量共存的是
A.(1)和(6) B.(3)和(4) C.(2)和(5) D.(1)和(4)
16.设计四种制备气体的方案:①用稀硝酸与锌粒反应制备氢气;②加热稀盐酸和二氧化锰制备氯气;③用稀硫酸和大理石反应制备二氧化碳气体;④加热氯酸钾和高锰酸钾混合物制备氧气。不宜采用的方案有哪些?
A.①③ B.②④ C.①②③ D.①②③④
17.用98%的浓![]() (
(![]() )配制1
)配制1![]() 的稀
的稀![]() 100
100![]() ,配制过程需用到的仪器,且先后顺序正确的是
,配制过程需用到的仪器,且先后顺序正确的是
①100![]() 量筒 ②10
量筒 ②10![]() 量筒 ③50
量筒 ③50![]() 烧杯 ④托盘天平 ⑤100
烧杯 ④托盘天平 ⑤100![]() 容量瓶 ⑥胶头滴管 ⑦玻璃棒
容量瓶 ⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥ C. ②③⑤⑥⑦ D. ④③⑦⑤⑥
18.鉴别下列各组物质,只能采用焰色反应的是
A.![]() 和
和![]() B.
B. ![]() 和
和![]()
C. ![]() 和
和![]() D.
D. ![]() 和
和![]()
19.b![]() 某金属与足量的稀硫酸反应,生成该金属的三价正盐和a
某金属与足量的稀硫酸反应,生成该金属的三价正盐和a![]() 氢气(标准状况),则该金属的相对原子质量为
氢气(标准状况),则该金属的相对原子质量为
A.![]() B.
B. ![]() C.
C. ![]() D.
D.
![]()
20.将![]() 配平后,离子方程式中
配平后,离子方程式中![]() 的化学计量数是
的化学计量数是
A.2 B.4 C.6 D.8
21.在无土栽培中,需配制一定量含![]() 、
、![]() 和
和![]() 的营养液。若用
的营养液。若用![]() 、
、![]() 和
和![]() 三种固体为原料来配制,三者的物质的量依次是(单位为
三种固体为原料来配制,三者的物质的量依次是(单位为![]() )
)
A.2、64、24 B.64、2、24 C.32、50、12 D.16、50、24
22.将 a g 含![]() 样品溶解在 b
样品溶解在 b![]() 0.l
0.l ![]() 的硫酸中,再加入 c
的硫酸中,再加入 c![]() 0.1
0.1 ![]() 的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中
的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中![]() 的纯度是
的纯度是
A. ![]() B.
B. ![]()
C.![]() D.
D.![]()
23.将标准状况下的a![]() 氯化氢气体溶于1000
氯化氢气体溶于1000![]() 水中,得到的盐酸的密度为b
水中,得到的盐酸的密度为b![]() ,则该盐酸的物质的量的浓度是
,则该盐酸的物质的量的浓度是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
二、(本题包括2小题,共27分)
24.(11分)A、B、C、D、E 5瓶透明溶液,分别是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种。
中的一种。
① A与B反应有气体生成 ② B与C反应有沉淀生成
③ C与D反应有沉淀生成 ④ D与E反应有沉淀生成
⑤ A与E反应有气体生成 ⑥ 在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是 。
(2)A是 ,B是 ,C是 ,D是 ,E是 。
(3)A与E反应的离子方程式是 。
D与E反应的离子方程式是 。
25.(16分)某中学学生将过氧化钠与水的反应作为研究性学习的课题。经过查资料、提出假设、进行实验设计,并通过实验得到验证结论。下面是他们的实验方案及实验现象。
| 实验序号 | 实验程序 | 实验现象 |
| 1 | 将水滴入盛有过氧化钠固体的试管中,配制成溶液,用带火星的木条检验生成的气体 | 反应激烈,有大量气体产生,能使该木条复燃 |
| 2 | 将实验1所得溶液分成两份。一份加入紫色石蕊试液 | 溶液变蓝且长时间不褪色 |
| 一份加入无色酚酞试液 | 溶液显红色,半分钟内褪色 | |
| 3 | 若把实验1所得溶液分成两份。一份加热至沸1 ~ 2 | 溶液显红色,但仍很快褪色 |
| 另一份加热至沸1 ~ 2 | 溶液显蓝色且很快褪色 | |
| 4 | 在变为蓝色的石蕊试液中滴加 | 蓝色褪去 |
| 5 | 若把实验1所得溶液中加入少许 | 溶液变红且不再褪色 |
| 一份加入紫色石蕊至沸 | 溶液变蓝且不再褪色 | |
| 6 | ①称取3.9 | 测得氧气体积为170 |
| ②等不再产生气体约10 | 又产生大量氧气,至反应完全以后,又测得产生了395 |
请仔细阅读有关内容后回答:
(1)写出过氧化钠与水反应的化学方程式: ,根据实验分析,过氧化钠与水反应除了课本所介绍的上述反应外存在另一反应,其化学方程式为 。
(2)写出实验5中“加入少许![]() 产生气体”时所发生反应的化学方程式 ,其中
产生气体”时所发生反应的化学方程式 ,其中![]() 的作用是
。
的作用是
。
(3)从以上实验结果分析。石蕊分子与酚酞分子相比较,它们的稳定性 (填“相等”或“前者大”或“后者大”)。
(4)综合分析上述实验,指出使变红的酚酞褪色的物质是 。
(5)若测定过氧化钠的含量(含氧化钠),气体流向从左到右,将完成实验6所需仪器从下图选择并连接好。
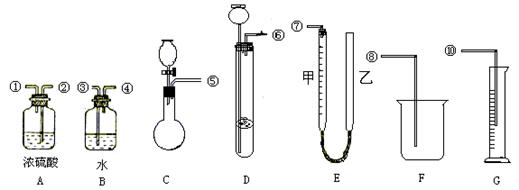
上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略):
或 。
为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,还应在盛过氧化钠样品的仪器中加 ,以确保氧化钠与水反应生成氧气,并在读取反应量具中液面的读数、求其体积的过程中,应注意 和 (填写字母编号)
a.视线与凹液面最低处相平
b.等待片刻,待测定液体体积的容器中液面不再上升时,立刻读数
c.读数时应上下移动一仪器,使两边液面相平
d.读数时不一定使两边液面相平
三、(本题包括2小题,共20分)
26.(8分)高锰酸钾和氢溴酸溶液可以发生下列反应,完成配平化学反应方程式并回答问题:
![]()
其中还原剂是 。若消耗0.1![]() 氧化剂,则被氧化的还原剂的物质的量是
氧化剂,则被氧化的还原剂的物质的量是
![]() ,转移电子个数为 。
,转移电子个数为 。
27.(12分)按下述实验过程填空:
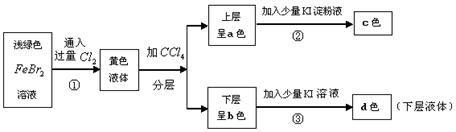
⑴a ,b ,c ,d 。
⑵分层后的分离操作为 。
⑶写出上述反应的离子方程式
① ;
② ;
③ 。
四、(本题包括1小题,共7分)
28. (7分)标准状况下,用一定量的水吸收氯化氢气体后制得浓度为11. 2![]() 、密度为1.12
、密度为1.12![]() 的盐酸。试计算1体积水吸收多少体积的氯化氢可制得上述盐酸。(本题中氯化氢的式量以36.5计,水的密度以1.00
的盐酸。试计算1体积水吸收多少体积的氯化氢可制得上述盐酸。(本题中氯化氢的式量以36.5计,水的密度以1.00![]() 计)
计)
高一化学参考答案
一、选择题(每小题只有一个答案符合题意,每小题2分,共42分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | D | A | C | B | C | D | D | A | D | B | A | C |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 | B | B | B | C | B | D | C | C | B | A | D |
二、(共27分)
24.(11分)
(1) AgCl (2分)
(2) Na2CO3 ;HCl ;AgNO3 ;BaCl2 ;NaHSO4 (5分)
(3) ![]() +2H+=CO2+H2O (2分)
+2H+=CO2+H2O (2分) ![]() (2分)
(2分)
25.(16分)
(1)2Na2O2 + 2H2O ==== 4NaOH + O2↑(2分)
Na2O2 + 2H2O ==== 2NaOH + H2O2 (2分)
 (2)2H2O2
2H2O + O2 ↑ (2分) 催化作用(1分)
(2)2H2O2
2H2O + O2 ↑ (2分) 催化作用(1分)
(3)前者大(1分)
(4)①H2O2 (1分)
(5)![]() (1分),⑤⑦或⑤④③⑩(4分), a c(2分)
(1分),⑤⑦或⑤④③⑩(4分), a c(2分)
三、(20分)
26.(8分)2,5,16,5,2,2,8(2分),![]() (1分),
(1分),
![]() (1分),0.5(2分),
(1分),0.5(2分),![]() (2分)
(2分)
27.(12分) ⑴a黄色,b橙色,c蓝色,d紫色。(4分)
⑵萃取(2分)
⑶ ①![]() ;(2分)
;(2分)
②![]() ;(2分)
;(2分)
③![]()
![]() 。(2分)
。(2分)
四、(7分)
28.(7分)
解 设制得盐酸溶液体积为1.00L。
1.00L该盐酸中含氯化氢的质量为:
1.00L×11.2mol·L-1×36.5g·mol-1=408.8g(1分)
其体积在标准状况下为:1.00L×11.2mol·L-1×22.4L·mol-1=250.88L(1分)
1.00L该盐酸中含水的质量为:1.00L×1120g·L-1-408.88g=711.2g(1分)
其体积为:![]() =0.7112L(2分)
=0.7112L(2分)
则标准状况下1体积水吸收氯化氢气体的体积为
![]() (2分)
(2分)
若直接列出总式,同样给分。