![]()
 厦门市翔安第一中学
厦门市翔安第一中学
 2007学年第一学期高一年期中考试卷
2007学年第一学期高一年期中考试卷
化学科
考试时间:90分钟 满分100分 命题:张清疆
相对原子质量:C-12, H-1, O-16, N-14, Li-7, Na-23, K-39, Rb-85, Cs-133, S-32,
一、单选题(每题 2分,共 25 题,合计50 分)
1、我国化工专家侯德榜所创立的“侯氏制碱法”誉满全球。“侯氏制碱法”的碱广泛用于玻璃、造纸、制皂、纺织工业,该碱是指( )
A.NaOH B.Na2CO3 C.NaHCO3 D.K2CO3
2、下列物质长期露置在空气中,因氧化而变质的是( )
A.K B.KOH C.Na2O D.Na2CO3
3、有关电解质的说法正确的是
A.纯水的导电性很差,所以水不是电解质
B.SO3水溶液的导电性很好,所以SO3是电解质
C.液态的铜导电性很好,所以铜是电解质
D.Na2O液态时能导电,所以Na2O是电解质
4、焰色反应每次都要用试剂洗净铂丝,这种试剂是( )
A. 碳酸钠溶液 B.氢氧化钠溶液 C.硫酸 D.稀盐酸
5、氧化还原反应的本质是( )
A、原子和离子之间的重新组合 B.物质的得氧和失氧
C、元素的原子或离子的电子转移 D.元素的化合价升高或降低
6、下列反应中,水只作为氧化剂的是( )
A.
|
C.C+H2O == CO+H2↑ D.Cl2+H2O=HCl+HClO
7、在反应3S+6KOH=K2SO3+2K2S+3H2O中,还原剂和氧化剂的物质的量比为( )
A.1 :1 B.2 :1 C.1 :2 D.3 :2
8、化学反应:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Fe3++2Br-
由上述反应可以推断氧化剂的氧化性强弱顺序为( )
A.Br2>Fe3+>I2 B.Fe3+>Br2>I2 C.I2>Br2>Fe3+ D.Br2>I2>Fe3+
9、下列物质的水溶液中,加入稀H2SO4或MgCl2都有白色沉淀生成的是
A.BaCl2 B.Na2CO3 C.KOH D.Ba(OH)2
10、下列离子组可以大量共存的是( )
A.Na+、Cu2+、Cl-、OH- B.H+、NO3-、Ca2+、Mg2+
C.H+、K+、CO32-、Cl- D.H CO3-、Na+、OH-、SO42-
11、下列各组溶液之间不能发生离子反应的是( )
A. NaCl和AgNO3 B. Na2CO3和硫酸
C. KNO3 和盐酸 D. Cu(OH)2和硝酸
12、下列离子方程正确的是 ( ) B
A 氢氧化铜与稀硝酸的反应:OH-+H+=H2O
B 将金属钠加入水中:Na+2H2O==Na++2OH-+H2
C 氢氧化钡溶液与硫酸反应:SO42-+Ba2+=BaSO4↓
D 硫酸氢钠与氯化钡溶液的反应:Ba2++SO42-=BaSO4↓
13、下列叙述中错误的是
A.化学反应中都伴随着能量变化
B.钠原子有强还原性,钠离子有弱氧化性
C.钠是一种强还原剂,可以把钛、锆、钽等金属从它们的盐的溶液中还原出来
D.焰色反应是某些金属元素特有的物理性质
14、鉴别苏打和小苏打溶液的最好试剂是
A. 盐酸 B. 澄清石灰水
C. 酚酞试液 D. CaCl 2 试液
15、某碱金属0.78g跟足量的水反应,生成0.01mol H2,这种金属是( )
A.Li B.Na C.K D.Rb
16、下列对碱金属的叙述中正确的是( )
A. 随着原子序数的增加金属性逐渐减弱 B.单质在空气中燃烧生成的都是过氧化物
C.单质与水反应生成碱和氢气 D.单质的熔沸点随着原子序数的增加而升高
17、某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②①
18、下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )
A.NaHSO4 B.KHCO3 C.Na2CO3 D.NH4NO3
19、在下列物质的溶液中,加入CaCl2溶液不产生沉淀,再加入NaOH溶液才产生沉淀的是( )
A. Na2CO3 B.AgNO3 C.NaHCO3 D.KOH
20、只用一种试剂和必要的实验操作就能鉴别NaHCO3、NaCl、K2SO4、KCl四种物质,
此试剂和实验操作是
A.盐酸、焰色反应 B.氢氧化钡溶液、焰色反应
C.盐酸、加热 D.氯化钡溶液、加热
21、钠和钾投入到足量水中,下列说法正确的是
A.等质量时,钾与水反应比钠与水反应更剧烈 ,且生成的氢气比钠多
B.等质量时,钠、钾与水反应生成的氢气一样多
C.等物质的量时,钠与水反应生成的氢气比钾多
D.等物质的量时,钠、钾与水反应转移的电子数一样多
22、下列说法不正确的是
A.SO42-的摩尔质量是96g/mol
B.1molH2中含有2molH
C.1molH2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数)
D..1molO2的质量为32g/mol
23、对于相同质量的二氧化硫和三氧化硫来说,下列关系正确的是
A、含氧原子的个数比为2∶3 B、含硫元素的质量比是5∶4
C、含氧元素的质量比为6∶5 D、含硫原子的个数比为1∶1
24、设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 16gO3与16gO2含有相同的氧原子数
B.2.3gNa+中含有的电子数为0.1NA
C. 1mol O2所含的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1 NA
25、将5.36gNa2CO3·XH2O置于坩埚中加热至衡重时,质量减少3.24g,则x值为( )
A.10 B.3 C.9 D.6
二、填空题
26.(10分)⑴碱金属在化学反应中容易_________电子,表现很强的___________性。若以R代表碱金属元素,则其氢氧化物的通式为__________________,它在水溶液中显碱性。由于钠______________________________________________,因此钠通常保存在_________中。取一小块钠,刚切开时,断面呈__________色,在空气中放置片刻,断面变暗,这是因为主要生成了__________。
⑵下列物质中 ①钠 ②过氧化钠 ③碳酸钠 ④碳酸氢钠(填序号)
可用于漂白织物、麦秆、羽毛的是 ;
可用于电光源上的是 ;
制糕点所用的发酵粉的主要成分是 ;
27、(12分)、(1)除去Na2CO3溶液中的NaHCO3,除杂试剂为 ,
离子方程式是: ;
(2)除去NaHCO3溶液中的Na2CO3,除杂试剂为
离子方程式是: 。
(3)将离子方程式CO32-+2H+==== CO2↑+H2O改写成化学方程式
⑷ Ag2O+H2O2=2Ag+O2↑+H2O反应中,__________是氧化剂;__________是还原剂;
______元素被氧化;电子转移总数为
28、(12分)①H2SO4的摩尔质量为 。1.204×1024个H2SO4分子物质的量为 ,
其中含 molO,含H的质量为 。
②0.5molNa投入 gH2O中,才能使溶液中Na+与H2O的个数比为1 :20
③加热10g NaHCO3一段时间后剩余固体质量为6.9g,则剩余固体中含有Na2CO3的质量为 g
29.(8分) 有一包固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、BaCl2、K2CO3和K2SO4中的一种或几种。现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸后,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,火焰呈黄色,隔蓝色钴玻璃观察,未见紫色火焰。
由上述实验现象推断:混合物中一定含有__________ _____;
一定不含有__ _______ ___;不能肯定是否含有_____________________。
写出上述⑵中反应的离子方程式:
30. (8分) 按以下装置图进行实验,填写有关现象及化学方程式
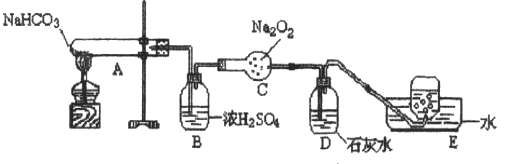
①A中现象是_________________________________
②B中浓硫酸的作用是_________________________________
③C中发生反应的化学方程式为__________________________ _______
④D中现象是____________________,反应的离子方程式是_____ _ _________
⑤E中收集的气体是____________________
![]()
 厦门市翔安第一中学
厦门市翔安第一中学
 2007学年第一学期高一年期中考答案
2007学年第一学期高一年期中考答案
化学科
考试时间:90分钟 满分100分 命题:张清疆
二、单选题(每题 2 分,共25 题,合计50分) 得分:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| B | A | D | D | C | C | C | A | D | B | C | D | C |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
| D | C | C | B | B | C | B | D | D | B | A | C |
|
二、填空题(50分)
26.(10分)⑴失,还原,ROH。由于钠易与空气中的O2和H2O反应,煤油。银白 ,Na2O
⑵(填序号)②, ①, ④ (各1分)
27、(12分)、(反应式2分,其他各1分)
(1)NaOH 溶液 , HCO3-+OH—==== CO32-+H2O ;
(2)CO2 CO32-+ CO2+H2O ==== 2HCO3-↓
(3) Na2CO3+2HCl=2NaCl+ CO2↑+H2O
⑷ Ag2O H2O2 O 2e- ;
28、(12分(各2分))①96g/mol, 2 mol , 8 , 4g 。 ② 189 ③ 5.3
29.(8分) (各2分) Na2CO3、Na2SO4、BaCl2 , CuCl2、、K2CO3和K2SO4 , NaCl、
BaCO3+2H+==== Ba2++CO2↑+H2O
30. (8分) (反应式2分,其他各1分)
①试管口有水珠 ②吸收水蒸气 ③2CO2+2Na2O2=2Na2CO3+O2↑
④石灰水变浑浊,Ca2++2OH-+CO2=CaCO3↓+H2O ⑤O2
命题说明:
1.命题指导思想:注重考察考生对所学相关课程“双基”的掌握程度
2.试卷结构:基本上采用了2004年高考中的独立化学卷结构,试卷包括选择题和非选择题两部分,选择题50分,非选择题50分。选择题均为单选题。
3.试题注重对考生“双基”的考察,强调化学学科的主干知识,不偏不怪。基本覆盖了高一化学第一、二章的主干内容及第三章第一节物质的量,紧扣中学化学教学大纲和中学化学教材,有利于学生对化学知识的掌握与提高。
4.试卷强调了对能力的考察。选择题的干扰项功能较强,加强了试题的甄别能力。
本卷适合普通中学学生,估计难度值:0.7,