济南市高一化学试题(2001、1)
注意事项:
本试题分为第Ⅰ卷和第Ⅱ卷,第Ⅰ卷选择题60分,第Ⅱ卷非选择题40分,共100分。考试时间为100分钟。第Ⅰ卷用答题卡答题,第Ⅱ卷用钢笔或圆珠笔直接答在试卷上。
原子量:H 1 C 12 O 16 F 19 Na 23 S 32 Cl 35.5 I 127 Ba 137
第Ⅰ卷(选择题共60分)
一、选择题(本题包括20小题,每小题2分,共40分。每小题![]() 选项符合题意。)
选项符合题意。)
1.波尔多液农药不能用铁制容器盛放,是因为铁能与农药中的硫酸铜反应。在该反应中,铁
A、是氧化剂B、是还原剂
C、是催化剂D、发生了还原反应
2.下列各组中的离子,能在溶液中大量共存的是
A、![]() 、
、![]() 、
、![]() 、
、![]() B、
B、![]() 、
、![]() 、
、![]() 、
、![]()
C、![]() 、
、![]() 、
、![]() 、
、![]() D、
D、![]() 、
、![]() 、
、![]() 、
、![]()
3.铜丝被加热到红热后才能在氯气里燃烧。下列有关叙述中正确的是
A、铜丝跟氯气的反应是吸热反应
B、铜丝在氯气里燃烧生成白烟
C、反应生成的氯化铜溶于少量水所得浓溶液呈蓝色
D、参加反应的铜和氯气具有的总能量高于反应生成的氯化铜具有的总能量
4.下列离子方程式中,书写正确的是
A、盐酸滴在锌粒上:![]()
B、氯化钡溶液滴入稀硫酸中:![]()
C、大理石跟稀盐酸反应:![]()
D、硫酸铜溶液与氢氧化钠溶液混合:![]()
5.实验室中少量金属钠可保存在
A、四氯化碳里B、汽油里
C、煤油里D、水里
6.下列物质放置在空气中,![]() 因为发生氧化还原反应而易变质的是
因为发生氧化还原反应而易变质的是
A、Na B、NaOH
C、NaCl D、![]()
7.金属钠比金属钾
A、金属性强B、还原性强
C、原子半径大D、熔点高
8.在空气中长时间放置少量金属钠,最终产物是
A、![]() B、NaOH
B、NaOH
C、![]() D、
D、![]()
9.![]() 的摩尔质量为
的摩尔质量为
A、18 B、18g
C、18mol D、18g/mol
10.在标准状况下,相同质量的下列气体中体积最大的是
A、![]() B、
B、![]()
C、![]() D、HCl
D、HCl
11.体积相同,溶质的物质的量浓度也相同的不同溶液中,一定含有相同的
A、溶质质量B、溶质分子数
C、溶质离子数D、溶质的物质的量
12.下列物质中,属于纯净物的是
A、氯水B、盐酸
C、液氯D、漂粉精
13.下列物质中,![]() 使淀粉碘化钾溶液变蓝的是
使淀粉碘化钾溶液变蓝的是
A、氯水B、溴水
C、碘水D、碘化钾
14.下列物质中属于非电解质的是
A、酒精B、石墨
C、食盐D、氯气
15.已知:![]() 是吸热反应,则
是吸热反应,则![]()
A、是放热反应B、是吸热反应
C、既不是放热反应,也不是吸热反应D、无法判断是吸热反应还是放热反应
16.下列变化需加适当的氧化剂才能实现的是
A、![]() →NaOH B、
→NaOH B、![]()
C、![]() D、
D、![]()
17.下列物质分别置于空气中并进行下述相应操作时,质量增加且颜色发生变化的是
A、碳酸钠晶体,加热B、浓硫酸,放置
C、氧化钠,加热D、胆矾,加热
18.下列因素中,对气体体积大小的影响通常可以忽略不计的是
A、分子数目B、分子体积
C、温度D、压强
19.为防止吸入氯气中毒,可用浸有某种溶液的毛巾捂住口鼻,这种溶液可以是
A、NaOH溶液B、稀![]()
C、![]() 溶液D、NaCl溶液
溶液D、NaCl溶液
20.分液漏斗是用于把密度不同且互不相溶的液体分离开的仪器。下列各组物质中,能用分液漏斗进行分离的是
A、四氯化碳和液溴B、汽油和花生油
C、酒精和水D、苯和食盐水
二、选择题(本题包括10小题,每小题2分,共20分。每小题有![]() 选项符合题意。若正确答案包括两个选项,只选一个且正确的得1分;只要选有错误选项该小题就为0分。)
选项符合题意。若正确答案包括两个选项,只选一个且正确的得1分;只要选有错误选项该小题就为0分。)
21.下列各同组中的两个不同反应(在溶液中进行),可用同一离子方程式表示的是
A、![]()
B、![]()
C、![]()
D、NaOH+![]()
22.下列物质分别与水反应时,水作还原剂的是
A、![]() B、
B、![]()
C、Na D、![]()
23.相同物质的量的碳酸钠和碳酸氢钠分别跟足量同浓度的盐酸充分反应,则
A、消耗的盐酸同样多B、放出的二氧化碳同样多
C、碳酸钠消耗盐酸多D、碳酸氢钠放出的二氧化碳多
24.下列关于盐酸性质的叙述中正确的是
A、只有酸性,无氧化性、还原性B、有酸性和氧化性,无还原性
C、有酸性和还原性,无氧化性D、既有酸性,又有氧化性、还原性
25.下列金属中,不能从硫酸铜溶液里置换出铜的是
A、Hg B、Zn
C、Fe D、K
26.将盛满氯气的试管倒立在水槽中,在日光照射下至不再反应,试管中残留的气体约占试容积的
A、1/2 B、1/3
C、1/4 D、1/6
27.物质的量浓度相同的NaCl、![]() 、
、![]() 三种溶液,当体积比为3:2:1时,三种溶液中
三种溶液,当体积比为3:2:1时,三种溶液中![]() 数目之比为
数目之比为
A、1:1:1 B、1:2:3
C、3:2:1 D、3:4:3
28.2.0mol/L NaCl溶液中,NaCl质量分数为ω%,则该溶液的密度是
A、11.7ω g/![]() B、
B、![]()
C、![]() D、
D、![]()
29.根据下列三个化学方程式判断有关物质的还原性由强到弱的顺序为
![]() ,
,![]()
![]()
A、![]() B、
B、![]()
C、![]() D、
D、![]()
30.VL氯气跟氢气的混合气体用电火花引燃后恢复至原状态,气体体积仍为VL;用足量烧碱溶液能将反应后的气体完全吸收,则原混合气体中氯气跟氢气的物质的量之比值可能
A、=1 B、>1
C、<1 D、为任意正数
第Ⅱ卷(非选择题,共40分)
三、(三题包括6小题,共20分)
31.(4分)从下面关于钠跟水反应的实验操作和现象的叙述中,分析钠具有的物理、化学性质,填写在相应的横线上。
用小刀从金属钠上切下一小块钠,投入水中_______________________________________。
钠浮在水面上,立刻熔化成一个银白色闪亮的小球____________________________________
_________________________________。
小球继续跟水作用,发出嘶嘶声,并迅速向各个方向游动,体积缩小,至完全消失____________________________________________________________________________。
向反应后所得溶液中滴入酚酞试液,溶液呈红色____________________________________
_________________________________________________________________。
32.(2分)写新制的氯水中分子和离子的化学式:____________________________________
33.(2分))用离子方程式表示下列现象发生的原因。
(1)用自来水配制的![]() 溶液浑浊__________________________________________。
溶液浑浊__________________________________________。
(2)用自来水配制的KI溶液呈黄色_____________________________________________。
34.(2分)用37%的浓盐酸(ρ=1.19g/![]() )配制250mL 2mol/L稀盐酸。下列操作中,
)配制250mL 2mol/L稀盐酸。下列操作中,
(1)会造成所配溶液浓度偏高的是(填序号,下同)_______________________________;
(2)使溶液浓度偏低的是_____________________________________________________。
①量取浓盐酸的酸式滴定管中有少量水;②稀释浓盐酸的烧杯中存有少量水;③250mL容量瓶中存有少量水;④量取浓盐酸时,正确读滴定管液面起点,但府视读液面终点;⑤量取浓盐酸时,正确读液面起点,仰视读终点;⑥稀释浓盐酸的烧杯只洗涤1次。
35.(6分)(1)写出工业上生产漂白精主要反应的化学方程式,标出电子转移的方向和数目,并指出氧化剂和还原剂。
_______________________________________________________________________________
氧化剂是_____________________,还原剂是___________________________________。
(2)写出漂白粉中的次氯酸钙与空气里的二氧化碳、水蒸气反应的化学方程式。
___________________________________________________________________________。
36.(4分)现有一定量含有![]() 杂质的
杂质的![]() 试样,请用下图的实验装置测定
试样,请用下图的实验装置测定![]() 试样的纯度,填写下列空白:
试样的纯度,填写下列空白:
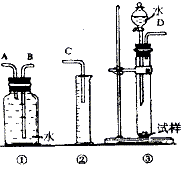
(1)装置接口的连接顺序是(填接口字母)
__________________________________________________。
(2)写出实验中![]() 、
、![]() 分别跟水发生反应的化学方程式:_________________________________,___________________________________ 。
分别跟水发生反应的化学方程式:_________________________________,___________________________________ 。
四、(本题包括2小题,共10分)
37.(2分)在![]() 反应中,0.25mol
反应中,0.25mol ![]() 离子参加反应共转移2mol电子,则x=_______________;在
离子参加反应共转移2mol电子,则x=_______________;在![]() 中B的化合价为___________。
中B的化合价为___________。
38.(8分)下图各方框内的字母分别表示一种反应物或生成物(反应生成的水或加入的水均略去)。已知A、D、G、H的焰色反应均呈黄色,且都是化合物,C为白色沉淀,E在通常条件下是一种黄绿色的气体单质,F是一种无色无刺激性气味的气体。
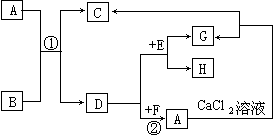
(1)推断6种物质的化学式:A_______________、B_______________、C_______________、D_______________、G_______________、H_______________。
(2)写出图中①、②两步反应的离子方程式。
①_____________________________________________________
②_____________________________________________________
五、(本题包括2小题,共10分。)
39.(6分)将10.93g氯化钠、氯化钡、碘化钠的混合物溶于水后,通入足量氯气至反应完全,将所得溶液蒸干并灼烧后,得残留固体9.10g。将残留固体再溶于水,加入足量碳酸钾溶液,所得沉淀经过滤干燥,质量为1.97g。计算原混合物中氯化钠的物质的量。
40.(4分)2.30g金属钠在空气中充分燃烧后,将生成物加入到96.90g水中,所得氢氧化钠溶液密度为1.04g/![]() ,计算该溶液中氢氧化钠的物质的量浓度。
,计算该溶液中氢氧化钠的物质的量浓度。
参考答案
一、(共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | A | D | B | C | B | D | A | D | C | D | C | D | A | A | B | C | B | C | D |
二、(共20分)
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | BC | A | BC | D | AD | A | D | C | D | AB |
三、(共20分)
31.(共4分)钠质软(1分)钠银白色,密度比水小,溶点低;钠跟水反应放热(1分)钠跟水反应剧烈,产生气体(1分)反应生成碱(1分)
32.(共2分)![]() 、
、![]() 、HClO,
、HClO,![]() 、
、![]() 、
、![]() (
(![]() 可答可不答)
可答可不答)
33.(共2分)(1)![]() (1分)
(1分)
(2)![]() (1分)
(1分)
34.(共2分)④(1分)①⑤⑥(1分)
35.(共6分)(1)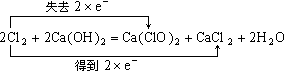
(化学方程式1分,得失电子各1分)
![]() (或氯气)(1分)
(或氯气)(1分)![]() (或氯气)(1分)
(或氯气)(1分)
(2)![]() (1分)
(1分)
36.(共4分)(1)D接A,B接C(2分)
(2)![]() (1分)
(1分)
![]() (1分)
(1分)
四、(共10分)
37.(共2分)4(1分)+3(1分)
38.(共8分)(1)![]()
![]()
![]() NaOH NaCl NaClO(各1分)
NaOH NaCl NaClO(各1分)
(2)①![]() (1分)
(1分)
②![]() (1分)
(1分)
五、(共10分)
39.解:![]() (灼烧升华)
(灼烧升华)
![]()
300g 117g 183g
x 10.93g-9.10g=1.83g
![]()
![]() ………………………………………………………………(2分)
………………………………………………………………(2分)
![]()
208g 197g
y 1.97g
![]() …………………………………………………………………(2分)
…………………………………………………………………(2分)
原有的![]() ………………………(2分)
………………………(2分)
答:原混合物中含氯化钠0.1mol。
40.解:由![]()
![]()
得![]() …………………………………………………………(1分)
…………………………………………………………(1分)
92g 32g 4mol
2.30g x y
![]() …………………………………………………………………(1分)
…………………………………………………………………(1分)
![]() ……………………………………………………………(1分)
……………………………………………………………(1分)
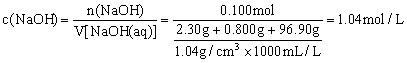 …………………(1分)
…………………(1分)
答:所得溶液中氢氧化钠的浓度为1.04mol/L。
说明:39、40题其它合理解法同样得分。