《硫和硫的化合物、环境保护》单元测试题
一。选择题(18×3=54分,每小题有1个答案符合题意)
1.下列物质不属于“城市空气质量日报”报道的是( )
(A)二氧化硫 (B)氮的氧化物 (C)二氧化碳 (D)悬浮颗粒
2.下列有关臭氧的说法错误的是( )
(A)臭氧和氧气是氧的同素异形体
(B)具有强氧化性可做脱色剂、消毒剂
(C)在高压放电条件由氧气制备
(D)臭氧层中臭氧含量很高,可以吸收紫外线,是人类和生物的保护伞
3.下列对硒元素的有关叙述、正确的是( )
(A)硒化氢较硫化氢稳定 (B)单质硒是一种半导体材料
(C)碲酸的酸性比硫酸的酸性强 (D)2Fe+3Se![]() Fe2Se3
Fe2Se3
4.吸进人体内的O2,有2%转化为氧化性极强的活性氧副产物,如![]() 等,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用含硒化合物Na2SeO3清除人体内的活性氧。在消除活性氧时,Na2SeO3的作用是( )
等,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用含硒化合物Na2SeO3清除人体内的活性氧。在消除活性氧时,Na2SeO3的作用是( )
(A)还原剂 (B)氧化剂
(C)既是氧化剂,又是还原剂 (D)以上均不是
5.下列变化中可以说明SO2具有漂白性的是( )
(A)SO2通入酸性高锰酸钾溶液中红色褪去
(B)SO2通入品红溶液红色褪去
(C)SO2通入溴水溶液中红棕色褪去
(D)SO2通入氢氧化钠与酚酞的混合溶液红色褪去
6.下列对硫酸的叙述正确的是( )
(A)因浓硫酸具有强氧化性,故不可用它来干燥氢气
(B)浓硫酸不活泼,可用铁铝容器存放
(C)浓硫酸有强氧化性,稀硫酸不具有氧化性
(D)浓硫酸难挥发,可用来制HF、HCl等挥发性酸
7.下列反应硫酸表现氧化性的是( )
(A)实验室用浓硫酸干燥氯气、氯化氢等气体
(B)将KI与浓硫酸混合,有紫色蒸气产生
(C)浓硫酸与氧化亚铁反应,会生成硫酸铁
(D)用浓硫酸在木制品上“烙”字画
8.向盐酸中加入浓硫酸会有白雾产生,下列叙述中与此现象无关的是( )
(A)浓硫酸具脱水性 (B)浓硫酸具有吸水性
(C)盐酸具有挥发性 (D)气态物质的溶解度随温度的升高而降低
9.在某无色溶液中,加入BaCl2溶液有白色沉淀,再加稀硝酸,沉淀不消失,则下列判断正确的是( )
(A)一定有SO42- (B)一定有CO32-
(C)一定有Ag+ (D)可能有SO42-或Ag+
10.有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下述结论正确的是( )
(A)Na2SO3已部分被空气中的氧气氧化
(B)加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
(C)加硝酸后的不溶性沉淀一定是BaSO4
(D)此实验不能确定Na2SO3是否部分被氧化
11.下列有关过氧化氢的说明不正确的是( )
(A)H2O2是极性分子 (B)H2O2具有弱酸性
(B)H2O2既具有氧化性,又具有还原性 (D)H2O2易分解生成H2和O2
12.下列物质均具有漂白作用,其中一种与另外三种的漂白原理不同的是( )
(A)HClO (B)H2O2 (C)SO2 (D)O3
13.下列反应的离子方程式可用“H++OH-=H2O”来表示的是( )
(A)次氯酸和氢氧化钾 (B)硫酸和氢氧化钡
(C)硫酸氢钠和氢氧化钠 (D)氢氧化镁和盐酸
14.向X盐中通入过量的Cl2无现象,再滴入BaCl2有白色沉淀产生,最后加入稀HNO3仍有沉淀,则X是( )
(A)Na2SO3 (B)AgNO3 (C)Na2S (D)CaCl2
15.为方便某些化学计算,有人将98%的浓H2SO4表示成下列形式,其中合理的是( )
(A)H2SO4·2H2O (B)H2SO4·H2O (C)H2SO4·SO3 (D)SO3·![]() H2O
H2O
16.在一定体积的的18mol·L-1的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9mol,则浓硫酸的实际体积为( )
(A)等于50 mL (B)大于50 mL (C)等于100 mL (D)大于100 mL
17.已知由NaHS、MgSO4、NaHSO4组成的混合物,硫元素的质量分数为a%,则混合物中氧元素的质量分数为( )
(A)a% (B)2a% (C)1-1.75a% (D)1-0.75a%
18.为除去CO2中混有的SO2和O2,下列试剂使用顺序正确的是( )
①饱和的Na2CO3溶液、②饱和的NaHCO3溶液、③浓硫酸、④灼热的铜网、⑤碱石灰
(A)①③④ (B)②③④ (C)②④③ (D)③④⑤
二.填空题(21×2=42)
19.(1)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液。
铜屑在此状态下被溶解的化学方程式为________________________________________。
(2)在过氧化氢跟稀硫酸的混合溶液中,加入铜片常温下就生成蓝色溶液。写出有关化学方程式__________________________________________________。
20.硫酸具有以下(A)-(E)所示的性质,试选择正确答案编号填在①-②所示变化的相应空格处:
(A)在水中电离,并呈强酸性;(B)高沸点难挥发;(C)浓硫酸具有吸水性;(D)浓硫酸具有脱水性;(E)浓硫酸具有强氧化性;(F)浓硫酸溶于水入出大量热。
①铜片与浓硫酸共热产生二氧化硫气体______________________。
②将稀硫酸滴在一张纸片上,再烘干(纸片不接触灯焰),发现纸片中滴过酸液的部位先变黑最后留下一个洞_________________________。
③蔗糖晶体中滴入适量的浓硫酸,再在滴有浓硫酸处加滴2-3滴水。发现加水处立即黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味气体产生。_________。
21.过氧化氢具有漂白性。某同学研究过氧化氢跟水的反应,进行如下实验:向盛有少量过氧化钠固体的试管中滴加水,直至气体不再放出,加水稀释,将所得溶液平均盛放在两支试管中。一支试管中滴加酚酞试液,溶液变红,半分钟内红色褪去;另一支试管中加入少量二氧化锰,又有气体放出,待气体不再放出后,再滴加酚酞试液,溶液变红,持久不褪色,请写出:
(1)根据以上实验分析,过氧化钠跟水反应的反应可能是分两步发生的,写出第一步反应的化学方程式:____________________________________。
(2)加入二氧化锰后发生反应的化学方程式_____________________________,反应中二氧化锰的作用________________________________。
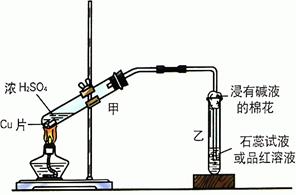 22.实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
22.实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成______________________。
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成________________________。
写出甲装置中发生的主要反应的化学方程式_____________________________。
(2)你在实验室中进行这个实验时,除了(1)小题中指到的实验现象外,还可以观察到许多其它的实验现象,请写出两种:____________________________________、___________________________________。
(3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式___________________________________。
23.根据下图回答问题:
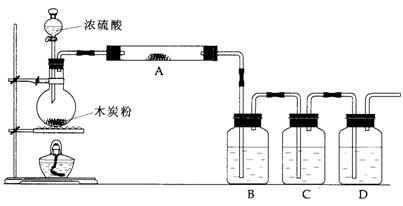
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。_______________________________。
(2)写出浓硫酸和木碳粉在加热条件下发生反应的化学方程式:_____________
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂和作用是____________。B中加入的试剂和作用是_________________。
D中加入的试剂和作用是_______________。
(4)实验时,C中应观察到的现象是___________________________________。
三.计算题
24.SO2是一种大气污染物,它可以在一定条件下通过下列反应来消除:
2CaCO3+2SO2+O2=2CaSO4+2CO2
如果SO2的转化率为97%,当消除6.6gSO2时,生成CaSO4的质量是多少?
答 案 卷
班级________________学号(后三位数字)_______姓名__________________________
一.(54分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
二.(42分)
19.(1)____________________________________________________________________。
(2)_______________________________________________________________________。
20.①___________________。②____________________。③_____________________。
21.(1)____________________________________________________________。
(2)______________________________________________,________________________。
22.(1)___________________________。__________________________________。
_________________________________________________________________________。
(2)_________________________________、_______________________________。
(3)______________________________________________________________________。
23.(1)__________________________________________________________________。
(2)__________________________________________________________
(3)
A___________________________________________________________________。
B___________________________________________________________________。
D___________________________________________________________________。
(4)___________________________________________________________________。
三.计算题
24.
参考答案
1C。2D。3B。4A。5B。6D。7C。8A。9D。10D。11D。12C。13C。14A。15D。16D。17C。18B。
19.(1)2Cu+O2+2H2SO4=2CuSO4+2H2O。(2)Cu+H2O2+H2SO4=CuSO4+2H2O。
20.①A和E。②BDE。③C、F、D、E。
21.(1)Na2O2+2H2O===2NaOH+H2O2。
(2)2H2O2====2H2O+O2↑;催化作用(或催化剂)。
22.(1)乙中品红褪成无色;甲中溶液显蓝色。Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O。
(2)装置甲试管内溶液变黑色浑浊;装置甲中试管上部有白雾;反应开始时铜片表面变黑并有气泡产生……
(3)Na2CO3+SO2=Na2SO3+CO2↑
23.(1)反应前先用小火加热烧瓶,B、C、D瓶中有气泡冒出,停止加热后,水会升到导管里形成一段水柱,证明装置不漏气。
(2)2H2SO4(浓)+C![]() 2H2O+2SO2+CO2
2H2O+2SO2+CO2
(3)A:无水硫酸铜。检验水。B:品红溶液。检验二氧化硫。D:澄清石灰水。检验二氧化碳。
(4)酸性高锰酸钾溶液的颜色不褪尽。
24.13.6g。