高一(上)化学期末考试试题(A卷)
一、选择题:
1.以下关于金属钠的叙述中正确的是( )
A.金属钠可保存在煤油中
B.金属钠可将铁从其溶液中转换出来
C.钠投入水中立即熔化成小球,说明钠的熔点低,且钠与水反应为放热反应
D.钠在空气中能发生缓慢氧化而发生自然
2.下列有关碱金属元素的说法不正确的是( )
A.碱金属的原子半径或离子半径一般随电子层数目的增多而增大
B.绝大多数碱金属的单质都是银白色金属
C.碱金属的单质都是由人工制得
D.碱金属的熔沸点随相对原子质量的增大而升高
3.下列物质中属于纯净物的是( )
A.磷在氯气中燃烧后的生成物 B.盐酸 C.液氯 D.淀粉KI溶液
4.氯水用于消毒是因为( )
A.氯水中含有氯分子 B.氯水中含有次氯酸分子
C.氯水中含有氯离子 D.氯水中含有氢离子
5.在下列反应中,属于离子反应同时又属于有颜色变化的是( )
A.BaCl2溶液和K2SO4溶液反应 B.点燃H2和Cl2的混合气体
C.NaOH和CuSO4溶液 D.Ag放入盐酸中
6.根据下列反应:(1)2Fe3++2I-![]() 2Fe2++I2(2)Br2+2Fe2+
2Fe2++I2(2)Br2+2Fe2+![]() 2Br-+2Fe3+判断离子的还原性由强到弱的顺序是( )
2Br-+2Fe3+判断离子的还原性由强到弱的顺序是( )
A.Br->Fe2+>I- B.I->Fe2+>Br C.Br->I->Fe2+ D.Fe2+>I->Br-
7.氢化钠是一种白色的离子晶体,NaH与水反应放出H2,下列叙述正确的是( )
A.氢化钠在水中显酸性 B.NaH中氢离子可以被还原成H2
C.氢化钠中氢离子半径比锂离子半径大 D.氢化钠中氢离子的电子排布与氦原子相同
8.下列微粒半径之比大于1的是( )
A.Cl-/Cl B.Na+/k+ C.Br-/I- D.Rb/K+
9.鉴别HCl和Cl2两种气体时,应选用( )
A.AgNO3溶液 B.湿润的蓝色石蕊试纸
C.润湿的红色石蕊试纸 D.湿润的淀粉KI溶液
10.取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
A.Ⅰ中溶液分层,下层呈紫红色 B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色 D.Ⅳ中溶液不分层,溶液由棕黄色变成黄绿色
11.a mol H2和2a mol氦气具有相同的( )
A.分子数 B.原子数 C.质子数 D.质量
12.下列说法错误的是( )
A.1mol任何物质都含有约6.02×1023个原子
B.0.012kg12C约含有6.02×1023个碳原子
C.使用物质的量时,应用化学式指明粒子的种类
D.1mol H2的质量是1g,它所占的体积约为22.4L/mol
13.在反应3Cl2+6KOH(浓)![]() KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为( )
KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为( )
A.5:1 B.4:1 C.1:5 D.1:4
14.在标准状况下有:①6.72L CH4 ②3.01×1023个氯化氢分子 ③13.6g硫化氢 ④0.2mol氨气。下列对这四种气体的关系从大到小表达不正确的是( )
A.体积:②>③>①>④ B.密度:②>③>④>①
C.质量:②>③>①>④ D.氢原子数:①>④>③>②
15.在Na2O2与水反应中,叙述正确的是( )
A.O2是氧化产物 B.NaOH是氧化产物
C.Na2O2是氧化剂,水是还原剂 D.Na2O2中,-1价的氧既得电子,又失电子
16.下列灭火剂能用于扑灭金属钠着火的是( )
A.干冰灭火剂 B.黄沙 C.干粉(含NaHCO3)灭火剂 D.泡沫灭火剂
17.在甲、乙、丙、丁四个烧杯中分别加入2.3gNa、6.2gNa2O、7.8gNa2O2和4.0g NaOH,而后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁溶液中溶质的质量分数大小顺序正确的是( )
A.甲=丁<乙<丙 B.丁<甲<乙=丙 C.丁<乙=丙<甲 D.丁<甲<乙>丙
18.碘缺乏病是目前已知的导致人类智力障碍的主要原因。为解决这一全国性问题,我国已经开始实施“智力工程”,最经济可行的措施是( )
A.食盐加碘(盐) B.面包加碘(盐) C.大量食用海带 D.注射含碘药剂
19.下列各组离子中,不能大量共存的是( )
A.H+、Cl-、Na+、I- B.Mg2+、NO3-、K+、Br-
C.H+、Na+、F-、ClO- D.Ag+、NO3-、Na+、CO32-
20.下列离子方程式书写正确的是( )
A.碳酸氢钠与盐酸反应:HCO3-+H+![]() CO2↑+H2O
CO2↑+H2O
B.锌与盐酸反应:Zn+2H++2Cl-![]() Zn2++2Cl-+H2↑
Zn2++2Cl-+H2↑
C.二氧化锰与浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.钾与水反应:K+2H2O![]() K++2OH-+H2↑
K++2OH-+H2↑
21.VL硫酸铁溶液中含有mgFe3+离子,则溶液中SO42-离子的物质的量浓度是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
22.配制1mol/L NaCl溶液250mL,在下列仪器中要用到的是( )
①托盘天平 ②量筒 ③容量瓶 ④滤纸 ⑤烧杯
⑥玻璃棒 ⑦酒精灯 ⑧试管 ⑨胶头滴管
A.①③⑤⑥⑦ B.②③④⑤
C.①②③⑤⑥⑨ D.②③⑤⑥⑧⑨
二、填空题
23.有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③水银 ④蔗糖 ⑤冰醋酸 ⑥KNO3溶液 填空回答:(填序号)
(1)以上物质能导电的是
(2)以上物质中属于电解质的是
(3)以上物质中属于非电解质的是
(4)以上物质中溶于水后水溶液能导电的是
24.在三个密闭容器中分别装有(A)NaOH和Na2CO3(B)Na2O2和NH4HCO3(C)Na2O2和Ca(HCO3)2,其中每种物质均为1 mol,将它们加热至300℃,经充分反应后,排出气体,写出各容器内的固体物质的名称。A B C 如果分别加入相同浓度足量的稀H2SO4,与残留物质完全反应,则消耗H2SO4的体积从大到小的顺序为
25.(1)实验室用二氧化锰跟浓盐酸反应制取氯气的离子方程式为
(2)高锰酸钾是常用氧化剂,在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气的离子方程式为
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为
(4)从氯元素化合价变化看,以上三种方法的共同点是
(5)比较以上三个反应,可以认为氧化剂的氧化能力从强到弱的顺序
三、推断题
26.根据下图的互变关系,回答下列问题:
(1)写出下列物质的化学式
A B C D E
(2)写出下列反应的化学方程式,是离子反应的写离子方程式
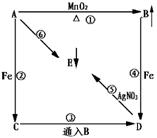 ①
①
②
③
④
⑤
⑥
27.A、B、C是由H、O、Na三种元素组成的三种化合物。甲、乙、丙是三种单质,分别由上述元素组成。上述单质和化合物之间存在如下反应关系:
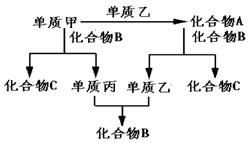
据此推断(写化学式)
(1)化合物A、B、C分别是A
B C
(2)甲、乙、丙分别是甲 乙 丙
四、实验题
28.除去下表各溶液中含有的少量杂质(括号内)填写下表
| 各物质的溶液(杂质) | 除去杂质所需试剂 | 离子方程式 |
| NaOH(Na2CO3) | ||
| KCl(KHCO3) | ||
| Na2CO3(NaHCO3) | ||
| NaHCO3(Na2CO3) |
29.在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,C中装有饱和食盐水,D中装有浓H2SO4,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。
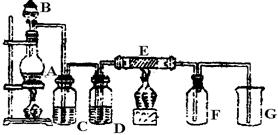
试回答:
(1)A、B、G中各装有什么药品:
(2)为什么从A中生成的气体一定要通过C、D两个装置?
(3)E中的现象为 ;生成的物质是 。
(4)写出A、G中发生反应的离子方程式和E中反应的化学方程式
五、计算题
30.将10g小苏打样品与足量盐酸反应生成的CO2气体通过足量的Na2O2后,得到1.6g气体,计算小苏打的纯度。
31.现有含Cl-的固体试样,其Cl-的质量分数为A%,为了确定试样是否合格,并简化计算过程,实验者用0.200mol/L的AgNO3标准液滴定已称量的试样配制的溶液,让滴入的AgNO3溶液的mL数正好等于样品中Cl-的质量分数的A值,求称取试样质量为多少?
参考答案
一、(共30分)1.AC(2分) 2.D(1分)3.C(1分)4.B(1分)5.AC(2分)
6.B(1分) 7.C(1分) 8.AD(2分) 9.BD(2分) 10.B(分) 11.B(1分) 12.AD(2分) 13.A(1分) 14.D(1分) 15.AD(2分) 16.B(1分)
17.B(1分) 18.A(1分) 19.CD(2分) 20.AC(2分) 21.A(1分)
22.C(1分)
二、(22分)23.(1)3.6(1分) (2)1、2、5(1分)(3)4(1分)(4)1、2、5(1分)
24.A.氢氧化钠 碳酸钠(2分) B.碳酸钠(2分)
C.碳酸钠 碳酸钙C>A>B(2分)
25.(10分)(1)MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(2)2MnO4-+16H++10Cl-![]() 2Mn2++5Cl2↑+8H2O(2分)
2Mn2++5Cl2↑+8H2O(2分)
(3)4HCl+O2![]() 2Cl2↑+2H2O
2Cl2↑+2H2O
(4)氯元素的化合价从-1升到0价(2分)
(5)KMnO4>MnO2>O2(2分)
三、26.(13分)(1)HCl Cl2 FeCl2 FeCl3 AgCl (2)②Fe+2H+![]() Fe2++H2↑
Fe2++H2↑
③2Fe2++Cl2![]() 2Fe3++2Cl- ④2Fe+3Cl2
2Fe3++2Cl- ④2Fe+3Cl2![]() 2FeCl3
⑤Ag++Cl-
2FeCl3
⑤Ag++Cl-![]() AgCl↓
AgCl↓
27.(6分)(1)Na2O2 H2O NaOH (2)Na O2 H2
四、28.略(8分)
29. (9分)(1)MnO2浓 HCl NaOH (2)除去HCl和H2O(气)否则会影响Cl2与Fe在高温下的反应,使生成物不纯 (3)棕色烟
FeCl3 (4)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O Cl2+2OH-
Mn2++Cl2↑+2H2O Cl2+2OH-![]() Cl-+ClO-+H2O 2Fe+3Cl2
Cl-+ClO-+H2O 2Fe+3Cl2![]() 2FeCl3
2FeCl3
五、30. 84%(6分) 31. 0.71g(6分)