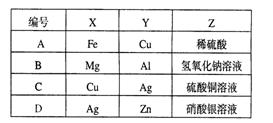
高二年级化学能力测试题[10]
[ ]1.下列有机物的命名不正确的是
A.3,3-二甲基-4-乙基庚烷 B.2,2-二甲基-1-戊烯 C.3-甲基戊烷 D.2-甲基-1,3-丁二烯
[ ]2.下列反应生成物为纯净物的是
A. 甲烷与氯气光照
B.氯乙烯加聚 C.乙醇与浓H2SO4共热
D.乙烯与氯化氢加成
[ ]3.有8种物质:①甲烷;②苯;③聚乙烯;④聚异戊二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯。既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是:
A.③④⑤⑧ B.④⑤⑦⑧ C.④⑤⑧ D.③④⑤⑦⑧
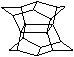 [ ]4.1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如下图分子,因其形状像东方塔式庙宇(pagoda—style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是
[ ]4.1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如下图分子,因其形状像东方塔式庙宇(pagoda—style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是
A.分子式为C20H20 B.一氯代物的同分异构体只有两种
C.分子中含有二个亚甲基(—CH2—) D.分子中含有4个五元碳环
[ ]5.将用于2008年北京奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯。下列说法错误的是
A. ETFE分子中可能存在“—CH2—CH2—CF2—CF2—”的连接方式
B. 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
C. 聚全氟乙丙烯分子的结构简式可能为![]()
D. 四氟乙烯分子中既含有极性键又含有非极性键
[ ]6.下列溶液中各微粒的浓度关系正确的是
A.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):c[(NH4)2SO4] > c(NH4HSO4) > c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA—)+c(A2—)
D.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
[ ]7.下列取代基或微粒中,碳原子都满足最外层为8电子结构的是
A.乙基(—CH2CH3) B.碳正离子[(CH3)3C⊕] C.碳化钙 (CaC2) D.碳烯 (:CH2)
[ ]
|
[ ]9.某无色溶液中加入过量的盐酸有沉淀生
|
溶液又有沉淀生成,原溶液中能大量存在
的离子组是
① Ag+、Cu2+、Na+、NO3-
② Ag+、Al3+、K+ 、NO3-
③Ag+、Ca2+、NO3- ④SiO32-、Al3+、K+
⑤Ag+、NH4+、H+、NO3- ⑥AlO2-、K+、NH4+
A .①②⑤ B .②③ C .②③④⑥ D .①②③④⑥
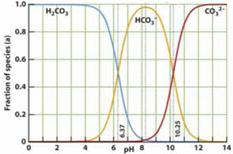 [ ]10.下图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是
[ ]10.下图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是
A .此图可完全根据1.0 mol/LHCl溶液滴定1.0mol/L碳酸钠溶液的实验数据绘出
B. 1.0 mol/LHCl溶液滴定1.0mol/L碳酸钠溶液恰好反应时呈中性
C. 二氧化碳溶液在血液中多以HCO3-的形式存在
D. 在pH为6.37及10.25时,溶液中[H2CO3]=[HCO3-]=[CO32-]
[ ]11.设N0为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,32 g氧气和32 g臭氧所含有的氧原子数都为2 N0
B.标准状况下,22.4 L辛烷完全燃烧,生成CO2的分子数为8 N
C.1 L 0.l mol·L—1的醋酸溶液中,离子和分子的总数为0.1 N0
D.0.1 mol铁在纯氧中充分燃烧,失去的电子数为0.3 N0
[ ]12.能正确表示下列反应离子方程式的是
A.过氧化钠固体与水反应:2O22—+2H2O == 4OH-+O2↑
B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
C.次氯酸钙溶液中通入少量SO2:Ca2++2 ClO-+H2O+SO2 == CaSO3↓+2HClO
 D.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
D.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
[ ]13.如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是
①CO、O2; ②Cl2、CH4; ③NO2、O2; ④N2、H2;
A .①② B .②④ C .③④ D.②③
[ ]14.下列是爱迪生电池分别在充电和放电时发生的反应:Fe + NiO2+2H2O![]() Fe(OH)2+ Ni(OH)2下列对爱迪生蓄电池推断错误的是
Fe(OH)2+ Ni(OH)2下列对爱迪生蓄电池推断错误的是
① 放电时,Fe参与负极反应,NiO2参与正极反应 ②充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH- ③ 放电时,电解质溶液中的阴离子向正极方向移动 ④ 放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+ ![]() ⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
A.只有③ B.③④ C.④⑤ D.①②⑤
[ ]15.下列各组物质间反应可能包括多步反应 , 其总的离子方程式正确的是
A. NaClO 溶液 中通入过量 SO2: C1O-+ SO2 + H2O= HClO +HSO3-
B. FeCl2在空气中被氧化: 4Fe2++O2+2H2O=4Fe3++4OH-
C. A1Cl3溶液中投入过量Na: A13++4Na+2H2O = A1O2-+ 4Na++ 2H2 ↑
D. FeBr2溶液中通入少量C12: 2Fe2++4Br-+3C12= 2Fe3++2Br2+6C1-
[ ]16.含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 | 36.1 |
| *燃烧热(kJ·mol-1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
* 燃烧热:1 mol物质完全燃烧,生成二氧化碳、液态水时所放出的热量。
根据表中数据,下列判断错误的是
A. 正庚烷在常温常压下肯定不是气体 B. 烷烃燃烧热和其所含碳原子数成线性关系
C. 随碳原子数增加,烷烃沸点逐渐升高 D. 随碳原子数增加,烷烃沸点和燃烧热都成比例增加
[ ]17.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是
A. CH3CH2CH2CH3 B. CH3CH(CH3)2 C. CH3C(CH3)3 D. (CH3)2CHCH2CH3
[ ]18.下列各组化合物,不论二者以什么比例混合,只要总质量一定,则完全燃烧时,消耗O2的质量和生成水的质量不变的是
A.CH4 C2H2 B.C2H6 C3H6 C.C2H4 C3H6 D.C2H4 C3H4
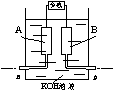 [ ]19.某甲烷—氧气燃料电池的结构如右下图所示,该电池的两个电极均由多孔碳制成,以30%KOH溶液为电解质溶液,气体由多孔碳孔隙逸出并在电极表面放电,其总反应的化学方程式为:CH4 + 2O2 + 2KOH
[ ]19.某甲烷—氧气燃料电池的结构如右下图所示,该电池的两个电极均由多孔碳制成,以30%KOH溶液为电解质溶液,气体由多孔碳孔隙逸出并在电极表面放电,其总反应的化学方程式为:CH4 + 2O2 + 2KOH![]() K2CO3 + 3H2O。下列说法中正确的是
K2CO3 + 3H2O。下列说法中正确的是
A.用多孔碳作电极,是为了增大气体与溶液的接触面积,加快气体的放电速率
B.若b处通入的气体为氧气,则B极为负极
C.当发生反应的O2为5.6L(标准状况)时,则有2mol电子发生转移
D.正极的电极反应为CH4 + 10OH--8e-![]() CO32- + 7H2O,放电一段时间后该极附近溶液 的pH降低
CO32- + 7H2O,放电一段时间后该极附近溶液 的pH降低
[ ]20.2005年诺贝尔化学奖被授予“在烯烃复分解反应研究方面作出贡献”的三位科学家。“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如2分子烯烃RCH=CHR’用上述催化剂作用会生成两种新的烯烃RCH=CHR和R’CH=CHR’。若让丙烯发生上述“复分解反应”,产物中最不可能含有的烯烃是
A.1—丁烯 B.2—丁烯 C.乙烯 D.丙烯
[ ]21.将0.2mol某烷烃完全燃烧后生成的气体全部缓慢通入盛有0.5L浓度为2mol/L的氢氧化钠溶液中,生成的碳酸钠与碳酸氢钠的物质的量之比1∶3,则该烷烃为
A.甲烷 B.乙烷 C.丙烷 D.丁烷
[ ]22.在20 mL pH=2的醋酸溶液中,加入V mLpH=12的NaOH溶液。则下列说法中正确的是
A.如果V=20,则所得混合溶液的pH大于7
B.如果所得混合溶液的pH=7,则V大于20
C.所得混合溶液中一定存在c(Na+) +2 c(H+) = c(CH3COO-) + c(OH-)
D.当V=20时,混合溶液中存在c(Na+) > c(CH3COO-) > c(H+)> c(OH-)
23.下列实验操作或对实验事实的叙述正确的是 (填序号)
①用25mL碱式滴定管量取24.00mLKMnO4溶液 ②实验室制取乙烯时,所用的无水酒精和浓硫酸的体积比为3∶1 ③实验室中不能用启普发生器来制取乙炔 ④在苯和溴水的混合物中加入铁作催化剂进行苯的溴代反应 ⑤实验室制取硝基苯时,为控制温度至55℃~60℃,可采用水浴加热 ⑥实验室配制氯化亚铁溶液时,应将氯化亚铁晶体先溶解在较浓盐酸中,然后再用蒸馏水稀释并加入少量铁粉。
24.在定量分析化学反应中各物质的计量关系时,可利用质量守恒、电荷守恒和得失电子守恒等规律将问题简单化,现有单质铁溶于稀硝酸反应的化学方程式可表示为:
aFe+bNO3-+cH+==dFe2++f Fe3++gNO↑+hN2O↑ +kH2O 试回答下列问题:
⑴b,c,d,f的数学关系式为______________ ⑵d,f,g,h的数学关系式为______________
⑶c,g,h的数学关系式为 。
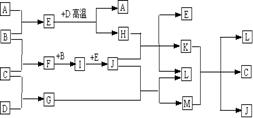 25.如图,常温下单质A、B为气体,单质C为固体,分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙丙同主族,E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去) 回答下列问题
25.如图,常温下单质A、B为气体,单质C为固体,分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙丙同主族,E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去) 回答下列问题
⑴ M的化学式为
⑵ 甲、乙两种元素还可以形成一种含有4个原子核和18个电子的化合物,该化合物的结构式为
⑶ E 与 D高温反应的化学方程式为为
K 与 M 在水溶液中反应的离子方程式为
⑷ 实验室在保存L溶液时,需加入少量D,理由是
实验室检验L的水溶液中的阳离子的方法是
⑸ 已知一定条件下每1mol F与单质B完全反应生成I放热98.0KJ,若2molF与1mol B在此条件下发生反应,达平衡时,放出热量为176.4KJ,则F的转化率是 ,平衡时F的物质的量为 ,若保持温度和压强不变(反应混合物都为气体)按下列四种配比作为起始物质充入,达到平衡时各物质的物质的量与上述平衡状态相同的是
A.4mol F 、2mol B B.2mol F 、1mol 、B 2mol I
C.1mol F 、0.5mol 、B 1mol I D.3mol 、I 1mol Ne
26.一定温度下,将3 mol A和1 mol B气体通入一容积为2 L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g),反应2 min后达到化学平衡状态(保持温度不变),此时测得容器中n(B) = n(C) = 0.8 mol。请回答下列问题:
xC(g),反应2 min后达到化学平衡状态(保持温度不变),此时测得容器中n(B) = n(C) = 0.8 mol。请回答下列问题:
⑴ 从开始反应至达到平衡状态,物质C的平均反应速率为 , x= ;
⑵ 在保持温度不变的情况下,若向达平衡后的容器中通入a mol氦气(氦气和A、B、C都不反应),原
平衡将 移动(选填“正向”、“逆向”或“不”);
⑶ 在保持温度不变的情况下,若向达平衡后的容器中再充入a mol C,原平衡混合物中B的体积分数
将 (选填“增大”、“减小”或“不变”);
⑷ 如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的体积分数与原平衡相同,则起始
时加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系为
[请写出一个同时含有n(A)、n(B)、n(C)的关系式]。
27.如果取0.1 mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH==8 。 试回答下列问题:
在含有A-、Na+、H+、OH-的水溶液中,如果出现下列关系请将它们在溶液中可能对应的溶质分别填在横线上:
⑴c(Na+)>c(A-)>c(OH-)>c(H+) ⑵c(A-)>c(Na+)>c(H+)>c(OH-)
⑶c(Na+)>c(OH-)>c(A-)>c(H+)
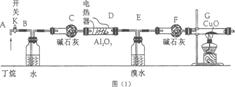 28.丁烷催化裂解可按两种方式进行:C4H10→C2H6+C2H4;C4H10→C3H6+CH4,某化学兴趣小组为了测定裂解气中CH4和C2H6的比例关系,设计实验如图(1)所示:
28.丁烷催化裂解可按两种方式进行:C4H10→C2H6+C2H4;C4H10→C3H6+CH4,某化学兴趣小组为了测定裂解气中CH4和C2H6的比例关系,设计实验如图(1)所示:
图(1)连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等。(注:CuO能将烃氧化成CO2和H2O;G后面装置已省略。)
(1)这三步操作的先后顺序依次是 (填写序号)。
(2)简要说明排空气的方法和证明空气已排尽的方法:
(3)B装置所起的作用是 。 (4)假定丁烷完全裂解,当(E和F)装置的总质量比反应前增加了0.7g,G装置中固体质量减少了1.76g,则丁烷的裂解产物中n(CH4): n(C2H6)=____ : (假定流经各装置中的气体能完全反应)
29.碳正离子[例如,CH3+,CH5+,(CH3)3C+等]是有机反应中重要的中间体。欧拉(G.Olah)因在此领域研究中的卓越成就而获荣获1994年诺贝尔化学奖。碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到;而CH5+失去H2,可以得到CH3+。
⑴CH3+是反应性很强的正离子,是缺电子的,其电子式是
⑵CH3+中4个原子时共平面,三个键角相等。键角应是
⑶(CH3)2CH+在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是 。
⑷(CH3)3C+去掉H+后将生成电中性的有机分子,其结构简式是 。
30.如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如图转化关系:
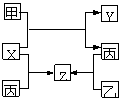 (1)若甲是短周期金属单质,乙、丙是短周期非金属单质,
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质,
X、Y、Z中只有一种是离子晶体,试推断:
①X的电子式是______________
②工业上有些气体中也含有一定量的Z成分,试列举一种气体______________。
③X与甲反应的化学方程式____________________________________________ _。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是深红棕色液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出甲、乙、丙三种物质的化学式甲________ ____、乙__________ __、丙________ ___ 。
②写出X与足量的甲在溶液中完全反应的离子方程式: 。
参考答案
1B 2D 3C 4A 5C 6A 7C 8D 9B 10C 11A 12B 13D 14B 15C 16D 17C 18C 19A 20A 21D 22B
23. ③⑤⑥
24. ⑴b,c,d,f的数学关系式为 c_-b=2d+3f
⑵d,f,g,h的数学关系式为2d+3f=3g+8h
⑶c,g,h的数学关系式为c=4g+10h
25.⑴ H2S
⑵ H-O-O-H
⑶ 4 H2O +
3Fe ![]() Fe3O4 +
4H2
2Fe3+ + H2S = S ↓+ 2Fe2+ + 2H +
Fe3O4 +
4H2
2Fe3+ + H2S = S ↓+ 2Fe2+ + 2H +
⑷ 防止Fe2+被氧化成Fe3+。 溶液中加KSCN溶液没现象,滴加氯水(或溴水)后变红(或滴加NaOH 溶液,先出现白色沉淀,后迅速转化为灰绿色,最后转化为红褐色)
⑸ 90% 0.2mol C
26. ⑴ 0.2 mol·(L·min)-1 4
⑵ 不
⑶ 不变
⑷ [n (A)+3/4n (C) ] : [n (B)+1/4n (C) ] = 3 : 1
27. ⑴: NaA
⑵: NaA和HA
⑶: NaA和NaOH
28.(1)②③①
(2)打开开关K,使丁烷气体流经各装置;
从G装置右边导管中收集一试管气体,用拇指堵住管口移至火焰,若无爆鸣声,则证明空气排尽
(3)通过观察气泡冒出的速度,调节开关K,控制气流
(4) 1:1
29. (2) 120°
(3 ) (CH3)2CHOH
(4) (CH3)2C=CH2
30.(1) ①![]() , ②水煤气等
③2Mg+CO2
, ②水煤气等
③2Mg+CO2![]() 2MgO+C
2MgO+C
(2) ①Cl2、 Fe、 Br2 ②3 Cl2+2 Fe2++4Br-==2 Fe3++2Br2+6Cl-