高二化学会考第一轮质量检测卷
班级 姓名 号数 成绩
(考试时间:90分钟;满分:100分)
本试卷分第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷为选择题,第Ⅱ卷为非选择题。
第Ⅰ卷(选择题 共46分)
相对原子质量:Mg-24 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Mn-55
一、选择题(下列各题只有一个正确答案。每小题 2分,共46分。)
1、污染大气并形成酸雨的主要物质是
A.CO B.NH3 C.SO2 D.HCl
2、下列互为同位素的是
A.金刚石和石墨 B.![]() C.乙烷和丙烷 D.T2O和D2O
C.乙烷和丙烷 D.T2O和D2O
3、不能由单质直接与O2反应生成的氧化物是
A.NO2 B.SO2 C.P2O5 D.Al2O3
4、在炼铁、制玻璃、制水泥三种工业生产中,都需要的原料是
A.纯碱 B.石灰石 C.石英 D.粘土
5、同温同压下,相同体积的氧气和氨气,可以肯定的是
A.质子数相等 B.分子数不等
C.都含有6.02×1023个分子 D.物质的量相等
6、实验室制取下列气体,所用发生装置相同的一组是
A.O2、H2 B.NH3、CH4 C.Cl2、O2 D.HCl、CO2
7、在下列化合物中,既有离子键又有共价键的是
A.MgBr2 B.H2O C.NH4Cl D.H2SO4
![]() 8、下列有机物的命名正确的是
O
8、下列有机物的命名正确的是
O
![]() A.CH3—CH2—CH—CH3 3—丁醇 B.CH3—O—C—CH3 甲酸乙酯
A.CH3—CH2—CH—CH3 3—丁醇 B.CH3—O—C—CH3 甲酸乙酯
OH
![]()
![]() CH3 CH3
CH3 CH3
C.CH3—C—C—H 1、2—二甲基丙烷
![]()
![]() H H
H H
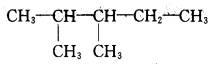 D.
2,3—二甲基戊烷
D.
2,3—二甲基戊烷
9、下列各组物质互为同系物的是
![]() A.C6H5CH2OH和C6H5OH B.CH2=CHCH3和CH=CH2
A.C6H5CH2OH和C6H5OH B.CH2=CHCH3和CH=CH2
CH3
C.C6H6和C2H2 D.CH3OH和CH3CH2OH
10、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c上有大量气泡;b、d相连时,d上有大量气泡产生,则这四种金属的活动顺序由强到弱为
A.a>b>c>d B.a>c>b>d C.c>a>b>d D.b>d>c>a
11、下列仪器在使用过程中,可以用酒精灯直接加热的是
A.烧杯 B.圆底烧瓶 C.试管 D.蒸馏烧瓶
12、下列反应中,水既不是还原剂也不是氧化剂的氧化还原反应是
A.钠与水反应 B.氧化钠与水反应
C.氟气与水反应 D.二氧化氮与水反应
13、下列离子方程式书写正确的是
A.醋酸加入氢氧化钠溶液中:H++OH-=H2O
B.铁跟氯化铁溶液起反应;Fe + 2 Fe3+=3 Fe2+
C.氢氧化钡溶液滴入硫酸中:Ba2++SO42-=BaSO4↓
D.碳酸钙与盐酸反应:CO32-+2 H+=H2O+CO2↑
14、用盐酸、氨水、苛性钠溶液中任何一种试剂都可鉴别的一组物质是
A.NaCl、Na2CO3 B.MgCl2、NH4NO3
C.FeCl2、FeSO4 D.AgNO3、AlCl3
15、化学反应C(s)+H2O(g) ![]() CO(g)+H2(g)(正反应为吸热反应)达到平衡,下列叙述中正确的是(
)。
CO(g)+H2(g)(正反应为吸热反应)达到平衡,下列叙述中正确的是(
)。
A.扩大容器的容积,平衡向正反应方向移动
B.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.加入水蒸气使容器压强增大,平衡向逆反应方向移动
D.加入固体碳,平衡向正反应方向移动
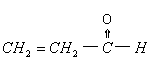
16.丙稀醛的结构简式为 ,下列试剂中,不能与其反应的是:
A.溴水 B.新制的Cu(OH)2
C.Na2CO3溶液 D.KMnO4酸性溶液
17、目前排放到空气中的CO2逐年增加,对此科学家最担心的是
A.会使空气中的氧含量下降,不足以供给人类呼吸
B.会使地球温度升高,冰川融化,生态失衡
C.会使人体吸进大量CO2,损害健康
D.会使石灰岩大量溶解,破坏自然风光
18、下列有机物完全燃烧时,所消耗O2与生成H2O的物质的量不相同的是
A.CH4 B.C2H6O C.C3H8 D.C3H8O2
19.常温下,下列各组物质相混合不能产生气体的是
A.铁与浓硝酸 B. 铜与硝酸
C. 铝与氢氧化钠溶液 D. 电石(CaC2)与食盐水
20、在NaOH溶液中能大量共存的离子组是
A.Fe2+、NO3— B. Ba2+、SO42—
C.Na+、SiO32— D. NH4+、HCO3—
21、今有MgCO3、NaHCO3、Al(OH)3三种物质的混合物162 g ,往其中加入过量盐酸,生成的CO2体积为22.4L(标准状态)。再向反应后的溶液中加入过量的NaOH溶液,得到29 g白色沉淀。该混合物中NaHCO3与Al(OH)3的物质的量之比是
A. 1:1 B. 1:2 C. 2:1 D. 2:3
22.某K2CO3样品中可能含有Na2CO3、KNO3、BaCl2三种杂质中的一种或二种。取15.6 g 该样品投入水中,样品完全溶解并得到澄清溶液。往此溶液中加入过量的CaCl2溶液,得到10g沉淀物。由以上反应事实推知,该样品中所含杂质的情况是
A. 肯定有Na2CO3、没有BaCl2 B.肯定有KNO3和BaCl2
C.肯定没有Na2CO3和BaCl2 D.肯定有KNO3、没有BaCl2,可能有Na2CO3
23、铁粉投入到溶质为FeCl3、CuSO4、HCl的混合溶液中,经充分反应后,将固体剩余物滤出并干燥,称其质量比加入的铁粉质量减轻16 g。此时滤液中Fe2+的物质的量浓度与原来混合溶液中Cu2+的物质的量浓度比为3:1(反应前后溶液的体积变化忽略不计),则溶液中SO42—与Cl—的物质的量浓度比是
A. 1:1 B. 1:2 C. 1:3 D. 1:4
宝莲中学高二化学会考第一轮质量检测卷
班级 姓名 号数 成绩_________
一、选择题答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 |
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共46分)
![]() 二.填空题(29分)
CH3
二.填空题(29分)
CH3
24、(6分)橡胶是异戊二烯 CH2==C—CH=CH2 经聚合反应后生成的聚合物,
![]() CH3
CH3![]()
该聚合物 -[-CH2—C==CH—CH2-]-n的名称是______________________。明矾[KAl(SO4)2·12H2O]溶于水,生成的胶状氢氧化铝可以吸附水里悬浮的杂质形成沉淀,所以曰常生活中,明矾常用于_______________________。焊接钢轨时所用的铝热剂是__________与氧化铁的混合物。
25、(7分)下表是元素周期表的一部分,针对表中元素,填写下列空白。
|
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
(1)Al3+结构示意图 。(2)MgCl2的电子式为 。
(3)F、Cl、S的氢化物中稳定性最强的是 (填氢化物名称)。
(4)甲烷分子的空间构型是 。
(5)用化学式表示N、P、Si的最高价氧化物的水化物酸性由弱到强的顺序是 。
(6)Na、Al最高价氧化物的水化物之间反应的化学方程式是
。
26.(5分)将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)

① 适量
过滤 过滤 ③
②
(1)沉淀A是 ,沉淀E是 。
(2)加入试剂①是 ,③是_________。
(3)滤液B中加入试剂②,发生的有关反应的离子方程式为_____________________________________________。
27.(3分)NO是污染大气的有毒气体。为了消除NO的污染,可将它跟氨气在催化剂作用下反应,生成和一种完全无污染的气态单质,该单质是空气的主要成分之一,这种单质是____;该反应的化学方程式是_________________________________。
28、(4分)写出下列反应的化学方程式
(1)过氧化钠和二氧化碳反应:_____________________________________。
(2)往苯酚(![]() )溶液中滴入浓溴水,产生白色沉淀:
)溶液中滴入浓溴水,产生白色沉淀:
______________________________________________________________。
29、(4分)从①CH3CHO、②CH3CH2OH、③C6H5OH、④HCOOC2H5、⑤CH3COO
中,选出适合下列要求的物质,将序号填入空格。
(1)能与NaOH溶液反应的是 。(2)能发生银镜反应的是 。
(3)与浓硫酸混合共热,用于实验室制乙烯的是 。
(4)其溶液滴入FeCl3溶液,溶液显紫色的是 。
30、(6分)简要回答下列各题。
(1)做氨喷泉实验时,没有看到喷泉现象,其可能的原因
(2)实验室里盛放碱液(如NaOH溶液)的试剂瓶用橡皮塞而不用玻璃塞的原因
.
(3)金属钠保存在煤油中的原因是
。
三、实验题。(11分)
31、(4分)为了达到下列实验目的,请从I项中选择合适的实验方法,从II项中选择可确定结论的现象,把所选答案的标号填写在相应的空格内。
| 实验目地 | ①检验生石灰里含有石灰石 | ②检验白色粉末是否含有Cl- | |
| 答案 | I | ||
| II | |||
I、实验方法:
A.加入硫氰化钾溶液 B.加入酸性KMnO4溶液
C.加入盐酸 D.加入硝酸酸化的AgNO3溶液
II、实验现象:
a.产生白色沉淀 b.有气泡产生 c.溶液呈红色 d.溶液紫色褪去
32、(7分)硝基苯是一种密度大于水且难溶于水的油状液体。请按下列实验室制取硝基苯的实验步骤填写有关空格。
(1)取4mL密度为1.84 g/cm3的浓硫酸和3 mL密度为1.38 g/cm3的浓硝酸配制混合酸。配制时,往烧杯中先加入_____________,后缓慢加入____________,并不断搅拌,以免酸液暴沸溅出。
(2)待混合酸冷却到50~60℃以下,约取3.5 mL混合酸于大试管中,再慢慢滴入1 mL苯,不断摇动,使混合均匀,然后放在60℃的____________中加热。有关反应的化学方程式为_____________________________________________。
(3)反应完毕,将混合溶液倒在一个盛有水的烧杯中,观察硝基苯的色态。然后用 将硝基苯与混合液分离。
(供选择的仪器:普通漏斗、长颈漏斗、分液漏斗)
(4)分离出的硝基苯中所残留的硝酸、硫酸可用__________________洗涤除去。
(供选择的试剂:溴水、氢氧化钠溶液、酒精)
四、计算题。(8分)
33、(2分)(2分)44.8升(标准状态)的氯化氢气体溶于1060 g水中,所得盐酸(密度为1.03 g/cm3)的物质的量浓度是多少?
34.(6分)实验室可用氯酸钾与浓盐酸反应制取氯气,该反应的化学方程式为:
KClO3+6HCl===KCl+3H2O+3Cl2↑
现将24.5 g KClO3跟150 mL12 mol/L盐酸充分反应,求:
(1)生成的Cl2在标准状态下体积为多少升?
(2)将反应后混合液稀释至500 mL,此时溶液中Cl— 的物质的量浓度为多少?
(KClO3摩尔质量为122.5 g/mol)