高二化学基础测试2
一、选择题(本大题共10分,每小题2分,每小题只有1个选项符合题意)
1.改变下列条件,一定会使气体反应的化学反应速率加快的是( )
①增加反应物的浓度 ②加入催化剂 ③升高温度 ④缩小气体的体积
A.①②③ B.①③④ C.②④③ D.③
2.在可逆反应中,混合物各成份的浓度比,一定等于各物质的分子系数比的是( )
A.起始浓度 B.转化浓度 C.平衡浓度 D.都不等于
3.在温度不变时,恒容器中进行反应,H22H-Q,若反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间应为( )
A.10 s B.12 s C.大于12 s D.小于12 s
4.在一定条件下,可逆反应达到化学平衡时,下列说法中正确的是( )
A.单位时间内反应物减少的分子数等于生成物增加的分子数
B.反应物的浓度一定等于生成物的浓度
C.混合物中各组分的质量分数是一定的
D.反应物和生成物的浓度比一定等于化学方程式的系数比
5.对某一可逆反应来说,使用催化剂的作用是( )
A.以同样程度改变正逆反应的速率
B.提高反应的平衡转化率
C.增大正反应速率,减小逆反应速率
D.改变平衡混合物的组成
二、多项选择题(本大题共40分,每小题4分,每小题有1~2个选项符合题意)
6.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的体积分数一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了合适催化剂。
A.①② B.②⑤ C.③⑤ D.④⑥
7.在一定条件下的可逆反应:2A(气)+2B(气)3C(气)+D(气),达到平衡的标志是( )
A.单位时间内生成2n mol A,同时生成n mol B
B.容器内的压强不随时间变化
C.容器内混合气体密度不随时间变化
D.单位时间内消耗1.5n mol C,同时消耗了0.5n mol D
8.把3 mol A和2.5 mol B混合于2 L的密闭容器中,发生反应的化学方程式为
3A(气)+B(气)C(气)+2D(气),5 min后反应达到平衡,容器内的压强变小。已知D的平均反应速率为0.1 mol/(L·min),下列结论错误的是( )
A.A的平均反应速率为0.15 mol/(L·min)
B.平衡时,C的浓度为0.125 mol/L
C.平衡时,B的转化率为20%
D.平衡时,容器内的压强为原来的0.8倍
9.对于可逆反应:A(气)+3B(气)2C(气)+Q(Q>0),下列图像能正确表示的是( )
 | |||
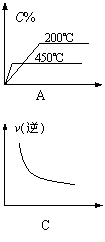 | |||
10.在一个活塞式可变容积的反应器里,通入1 mol N2和3 mol H2进行合成氨反应,在保持恒温、恒压条件下,再通入1 mol N2和3mol H2,则下列说法准确、完整的是( )
A.正反应速率增大,逆反应速率减小
B.正反应速率增大,逆反应速率减小,随后又恢复到原来的反应速率
C.化学平衡向正反应方向移动
D.化学平衡暂时被破坏,后又逐渐恢复到原平衡状态
11.在25 ℃时,把压强都为1.00×105 Pa的3 L NO和1 L O2压入一容积为2 L的真空容器中,保持温度在25 ℃,容器内压强最终为( )
A.1.5×105 Pa
B.1.5×105 Pa~3.0×105 Pa
C.3.0×105 Pa
D.小于1.5×105 Pa
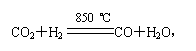 12.CO2和H2的混合气体加热到850 ℃时,可建立下列平衡:
12.CO2和H2的混合气体加热到850 ℃时,可建立下列平衡:
在一定温度下,平衡有90%的H2变成了H2O,且[CO2][H2]=[CO][H2O],则原混合气中CO2和H2的分子数之比是( )
A.1∶1 B.1∶5 C.9∶1 D.1∶10
13.对于可逆反应m A(气)+n B(气) p C(气)+q D(气),改变下列反应条件,肯定既能使反应速率发生变化,又能使化学平衡发生移动的是( )
A.改变反应物的量 B.改变体系的压强
C.改变体系的温度 D.加入催化剂
14.在密闭容器中发生反应a X(气)+b Y(气) c W(气)+d Z(气),若反应达到平衡后,保持温度不变,将气体压缩到原来的![]() 体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是( )
体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是( )
A.平衡向正反应方向移动
B.a+b>c+d
C.W的体积分数增大
D.X的转化率降低
15.已知工业上真空炼铷(Rb)的化学方程式为2RbCl+Mg![]() MgCl2+2Rb,对此反应能够进行的正确解释为( )
MgCl2+2Rb,对此反应能够进行的正确解释为( )
A.高温下,Mg2+的电子能力比Rb+弱
B.MgCl2对热的稳定性比RbCl强
C.在一定条件下绝大多数反应都有可逆性
D.Rb的沸点比Mg低,抽走Rb蒸气,平衡向正反应方向移动
三、填空题
16.甲、乙两瓶新制的氯水的浓度均为0.1 mol/L,如往甲瓶中加入适量的Na2CO3晶体,片刻后,甲、乙两瓶中HClO的物质的量浓度的关系是 。
A.甲>乙 B.乙>甲 C.甲=乙 D.无法确定
简述你选择的理由(用化学方程式和必要的文字说明)______________________。
17.某密闭容器中有如下可逆反应:A(气)+2B(气)2C(气)+Q,达到平衡后,若改变反应条件将变化的情况填入空格:(填增大、减小、不变)
(1)升高温度,B的转化率_______,v(正)_______,v(逆)_________。
(2)加入催化剂,A的物质的量________,v(正)_______,v(逆)________。
(3)缩小容器的体积,则C的物质的量_______,A的转化率_______。
(4)若温度和体积不变,反应从A、B起达到平衡,在这个变化过程中,容器内的气体密度_______,压强_______。
18.试用化学平衡的原理简要说明浓HNO3跟铜反应生成NO2,稀HNO3跟铜反应生成NO的原理____________________________。
19.紫色Cr2(SO4)3溶液中,加入NaOH到pH为4.6时溶液中有灰蓝色Cr(OH)3沉淀生成,Cr(OH)3在溶液中存在下列平衡:
![]()
![]() H
H![]()
紫色 灰蓝色 绿色
将Cr(OH)3分成a、b两支试管,在a管中加NaOH溶液,b管中加入H2SO4溶液,其颜色变化:a中呈现____色,b中呈现_____色,原因是_________________________。
20.合成氨工业中,原料气(N2,H2及少量的CO,NH3的混合气),在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,其反应是:
| |
(1)必须除去原料气中CO的原因是______________________。
(2)醋酸二氨合铜(I)吸收CO的生产适宜条件是_____________________。
(3)吸收CO后的醋酸二氨合铜(I)溶液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,醋酸二氨合铜(Ⅰ)溶液再生的条件是___________________。
 四、简答题
四、简答题
![]()
21.在硫酸工业生产中,通过下列反应使SO2转化为SO3,2SO2+O2 SO3+Q,已知常压下SO3的体积分数为91%,试回答下列问题:
(1)在生产中常采用过量的空气是为了________________________________;
(2)加热到400 ℃~500 ℃是由于___________________________________;
(3)压强应采用_________(填常压、加压、减压),原因是______________;
(4)常用浓硫酸来吸收SO3,而不用水,其原因是______________________;
(5)尾气中的SO2常用碱溶液吸收,是因为____________________________。
22.炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)Fe(固)+CO2(气)-Q,其平衡常数表达式![]() ,已知1100 ℃时,K=0.263。
,已知1100 ℃时,K=0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比_________,平衡常数K值_________;
(2)100 ℃时,测得高炉中[CO2]=0.025 mol/L,[CO]=0.1 mol/L。在这种情况下,该反应是否处于平衡状态________,(填是或否)。此时,化学反应速率是v正 ______v逆(填大于,小于或等于),其原因是________________。
五、计算题
23.把9.2 g N2O4晶体放在密闭容器中加热到一定温度,当反应N2O4(气)2NO(气)达到平衡后,混合气体的密度是相同条件下H2的密度28.75倍,求N2O4的转化率。
24.将等物质的量的A和B混合于2 L的密闭容器中,发生如下反应:
3A(气)+B(气)xC(气)+2D(气),经5 min后达到平衡时,测知D的浓度为0.5 mol/L,A∶B=3∶5,C的平均反应速率是0.1 mol/(L·min),求A的平衡浓度,B的平均反应速率和x值各多少?
参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 |
| B | B | C | C | A |
二、多项选择题
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| B | A | BD | AD | BD | D | C | C | BC | CD |
三、填空题
16.(3分)A。因氯水中存在如下平衡:Cl2+H2OHCl+HClO,当加入Na2CO3后,发生反应,Na2CO3+2HCl=2NaCl+CO2↑+H2O,使氯水中的平衡右移,增大了HClO的浓度。
17.(5分)(1)减小,增大,增大;(2)不变,增大,增大;(3)增大,增大;(4)不变,减小。
18.(3分)在Cu与HNO3溶液的反应中,还存在着另一可逆反应:3NO2+H2O2HNO3+NO,增大[HNO3]使平衡向着生成NO2的方向移动,减小[HNO3]使平衡向着生成NO的方向移动。
19.(4分)绿,紫,Cr(OH)3为两性物质,在溶液中有两种电离方式,当加入酸时,按碱式电离,使平衡向左移动,[Cr3+]增大,溶液变为紫色;当加入碱时,按酸式电离,使平衡向右移动,[CrO2-]增大,溶液变为绿色。
20.(6分)(1)防止催化剂中毒;(2)低温、加压;(3)高温、低压。
四、简答题
21.6分(1)通入过量空气,增大某一廉价反应物的浓度,使平衡向正反应方向移动,提高成本较高的SO2的转化率。
(2)在这个温度范围内,反应速率和SO2的平衡转化率都比较理想。
(3)常压。常压下400~500 ℃时,SO2的平衡转化率已经很高,而且加压必须增加设备投资和能量消耗,所以硫酸工业通常采用常压操作,并不加压。
(4)如果用水来吸收SO3容易形成酸雾,不利于SO3的吸收。
(5) 通常用氨水来吸收尾气中的SO2,然后再用硫酸处理,便生成尾气中的SO2和(NH4)2SO3,这样得到的尾气中的SO2气体含量较高,可返回车间作生成硫酸的原料,或作他用;同时得到(NH4)2SO3,可作肥料。
22.5分(1)增大,增大;(2)否,大于;此时[CO2]/[CO]<0.263,因为温度不变,K值不变,为增加[CO2]/[CO]的比值,需v正>v逆。
五、计算题
23.(6分)设N2O4转化的物质的量为x,根据反应后混合气体的密度求出x值,即可得出N2O4的转化率。
N2O4 2NO2
起始物质的量 0.1 0
转化物质的量 x 2x
平衡物质的量 0.1-x 2x
![]() ,x=0.06 mol,
,x=0.06 mol,
N2O4转化率=![]() 。
。
24.(6分)
(1)已知D的平衡浓度为0.5 mol/L,由C的平均反应速率求得C的平衡浓度为0.5 mol/L。根据D和C的平衡即可求出x值。
[C]平∶[D]平=x∶2 ∴x=2。
(2) 3A(气)+B(气)=2C(气)+2D(气)
转化浓度 0.75 0.25 0.5 0.5
由题意可知,A和B的起始物质的量相等,设其物质的量浓度为a,因其[A]平∶[B]平=3∶5,可得![]() ,
,
a=1.5 mol/L,
[A]平=1.5-0.75=0.75 mol/L,
v(B)=
![]() 。
。