高二化学基础测试4
一、 选择题(本大题共45分,每小题有1~2个选项符合题意)
1.点燃的镁条在下列气体中完全熄灭的是( )。
A.N2 B.CO2 C.He D.Cl2
2.下列金属氧化物中,不能用碳还原制得金属单质的是( )。
A.MgO B.Al2O3 C.Fe2O3 D.CuO
3.下列离子中氧化性最强的是( )。
A.Al3+ B. Fe2+ C.Ag+ D.H+
4.在炼铁、制玻璃和制水泥三种工业生产中都需用到的物质是( )
A. 纯碱 B.生石灰 C.石英 D.石灰石
5.下列各组物质中,均不能由单质直接化合而制取的是( )
A. NaCl、AlCl3、FeCl3 B. Cu2S、MgCl2、FeS
C. CuS、FeCl2、NH4Cl D. Mg3N2、Al2S3、Fe3O4
6.在铝和盐酸溶液反应中,氧化剂与还原剂的物质的量之比是( )
A .3∶1 B.1∶4 C .1∶1 D. 2∶1
7.将铁片放入下列各溶液中,反应后溶液质量增加,但无气体产生的是( )
A. CuCl2溶液 B. AgNO3溶液 C. Fe2(SO4)3溶液 D. 稀H2SO4
8.0.1 mol某元素的单质直接与Cl2反应,其质量增加7.1 g,则此元素是( )
A. K B. Mg C. Al D. Ca
9.下列溶液中通入过量二氧化碳,能产生白色沉淀的是( )
A. Ca(OH)2 B. CaCl2 C. Na2SiO3 D. NaAlO2
10.要使等体积的NaCl和AlCl3溶液中的Cl-完全沉淀,分别用去的AgNO3溶液的物质的量浓度和体积都相同,则NaCl溶液和AlCl3溶液的物质的量浓度比是( )
A.1∶1 B. 1∶2 C. 1∶3 D.3∶1
11.某溶液中含有较多的AlO2-,则溶液中可能存在的离子组合是( )
A. Al3+、NO3-、SO42- B.Mg2+、SO42-、Cl-
C. H+、NH4+、Cl- D. Na+、Cl-、OH-
12.将1.12 g铁粉加到25 mL 2 mol/L的FeCl3溶液中,充分反应后其正确的结论是(假设溶液总体积不变)( )
A.部分Fe被氧化
B.氧化产物与还原产物的物质的量之比为2∶5
C.溶液中Fe2+的物质的量浓度为2.4 mol/L
D.溶液中Fe3+和Fe2+的物质的量之比为1∶6
13.只用一种试剂,可鉴别Na2SO4、MgCl2、FeCl2、Al2(SO4)3四种溶液,此试剂是( )
A.Ba(OH)2溶液 B. 氢硫酸 C. NaOH溶液 D. AgNO3溶液
14.有2 mol/L的盐酸和硫酸各100 mL ,分别加入等质量的铁粉,反应结束后,所生成气体的质量比为2∶3,则向盐酸中加入铁粉的质量是( )
A. 11.2 g B. 2.3 g C. 5.6 g D. 8.4 g
15.已知空气—锌电池的电极反应为: 锌片:Zn + 2OH――2e-= ZnO + H2O 石墨:1/2O2+H2O + 2e- = 2OH- 据此判断:锌片是:
A. 负极,并被氧化 B. 负极,并被还原
C. 正极,并被氧化 D. 正极,并被还原
二、 填空题(本大题共30分)
16.地壳中含量最多的金属元素和含量最多的非金属元素形成的化合物的化学式为 ,此化合物与盐酸、NaOH溶液可发生化学反应,反应的离子方程式分别为 、 。
17.铝元素的单质既能与强酸反应、又能与强碱溶液反应,其离子方程式分别为 、 。
18.铝热剂是 和 的混合物,其反应的方程式为(举例) ,此反应可用于 。
19.铁元素位于周期表中 周期 族,是一种重要的过渡元素。在铁的化合物中铁显示正二价的原因是 ,显示正三价的原因是 。
20.将FeCl2、FeCl3、CuCl2三种溶液及Fe、Cu放入同一容器中,分别在下述情况下,哪些阳离子或金属单质能同时存在(不考虑极少量的H+):
(1)反应后Fe剩余,容器内还可能有 ;
(2)反应后溶液中有较多的Cu2+,容器内还可能有 或 。
21.铁粉与足量盐酸反应,离子方程式为 ,将所得溶液分放于二支试管中,第一支加入NaOH溶液,现象是 ,有关反应的化学方程式为 ,第二支中先加入KSCN溶液再通入足量Cl2,现象是 ,有关反应的离子方程式是 。
三、 推断题(本大题共10分)
22.某无色透明溶液,投入金属铝可放出H2。现有下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
(1)当生成Al3+时,可存在的离子有 ;
(2)当生成AlO2-时,可存在的离子有 。
23.电子工业常用30%的溶液腐蚀敷在塑料板上的铜箔,制成印刷电路板,现拟采用以下实验步骤从使用过的腐蚀废液中回收铜,并重新制得纯净的溶液,请在各步骤的括号内填写适当的试剂或生成物的化学式。
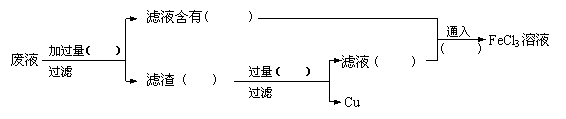 |
四、 计算题(15分)
24.将48.8 g铁粉和氧化铁粉末混合物,溶于800 mL的稀H2SO4中恰好完全反应(可以加热),在标准状况下得2.24 L氢气,反应后的溶液滴入KSCN溶液不变红色。求(1)原混合物中铁和氧化铁各多少克?(2)稀H2SO4的物质的量浓度是多少?
25.将100 mL 2 mol/L的AlCl3溶液跟4 mol/L的NaOH溶液混合后,得5.2 g Al(OH)3沉淀。求用去NaOH溶液多少毫升?
参考答案
一、 选择题
1.C
2.AB。 提示:在金属活动顺序表中,活泼金属K~Al,只能用电解的方法得到其单质,Zn~Cu的氧化物可被H2、CO、C等还原剂还原为单质。
3.C
4.D
5.C 。提示;常见的变价金属铁和铜,遇Cl2等强氧化剂被氧化至高价,即Fe与Cl2直接化合得FeCl3、Cu与Cl2直接化合得CuCl2;遇弱氧化剂被氧化为低价金属,即: Fe + S = FeS、2Cu + S = Cu2S。
6.A
7.C
8.BD
9.CD
10. D
11. D 提示:某溶液中含有较多的AlO2-,则溶液一定显碱性,含有较多的OH-。
12. CD
13. C
14.D 提示:2 mol/L的盐酸和硫酸各100 mL ,分别含有H+的物质的量为0.2 mol和0.4 mol,如果加入的铁足量,则生成氢气的质量比为1∶2,而实际放出氢气的质量比为2∶3,由此可知该质量的铁与盐酸反应时,铁过量,与硫酸反应时,铁不足。
即:铁与盐酸反应 Fe +2H+ = Fe2+ + H2↑
1 mol 2 mol 1 mol
0.2 mol 0.1 mol
∴ 铁与硫酸反应得到的氢气的物质的量为0.1 mol×2/3=0.15 mol,由上式可得铁的物质的量为0.15 mol×1/1=0.15 mol,质量为0.15 mol×56 g/mol=8.4 g。
15. A
二、填空题
16.Al2O3 ;Al2O3 + 6H+ = 2Al3+ +3H2O ,Al2O3 + 2OH-= 2AlO2-+ H2O
17.2Al + 6H+ = 2Al3+ +3H2↑;2Al + 2OH- + 2 H2O = 2AlO2-+ 3H2↑
18.金属氧化物 ; 铝 ; 2Al + Fe2O3 = 2Fe + Al2O3 ; 冶炼金属
19.四;Ⅷ ;铁原子失去最外层2个电子;铁原子失去最外层2个电子,次外层一个电子
20.(1) Fe2+,Cu (2) Fe3+,Fe2+ ; Cu,Fe2+
21. Fe + 2H+ = Fe2+ + H2↑;生成白色沉淀,很快变成灰绿色,又变成红棕色; FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3 ↓;溶液由浅绿色变为血红色;2Fe2+ + Cl2 = 2Fe3+ + 2Cl-,Fe3+ + SCN- = [Fe(SCN)]2+
22. (1) H+ Mg2+ SO42-; (2) OH- Ba2+ NO3-
23.
 滤液含有(FeCl2)
通入
滤液含有(FeCl2)
通入
加过量( Fe) FeCl3溶液
废液 过量( HCl ) 滤液(FeCl2) (Cl2)
过滤 滤渣(Cu,Fe)
过滤 Cu
四、计算题(15分)
24. (1) 氧化铁的质量为32 g,铁的质量为16.8 g
(2) 0.875 mol/L
提示:
设原混合物中有铁x mol,氧化铁y mol。
已知:n(H2)=2.24/22.4=0.1 mol
Fe + H2SO4 = FeSO4 + H2↑ Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
56 g 1 mol 1 mol
∴5.6 g 0.1 mol y mol
据题意反应后的溶液滴入KSCN溶液不变红色,则溶液中无Fe3+,可知上述反应后剩余的铁与反应生成的Fe2(SO4)3继续反应:
Fe + 2Fe3+ = 3Fe2+ n (Fe3+) = 2n(Fe2O3) = 2y
1 mol 2 mol
y 2y
∴ 5.6 g + 56y + 160y = 48.8 g ∴ y = 0.2 mol
氧化铁的质量为0.2 mol×160=32 g, 铁的质量为5.6 g + 0.2 mol×56 g/mol=16.8 g
25.50 mL或183.33 mL。