高二化学第一学期期中考试试卷(A卷)
说明:1.满分:100分;考试时间:90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cu 64
一选择题(每题只有一个正确答案,每题3分,共45分)
1.下列元素不属于氮族元素的是( )
A. N B. As C. S D. P
2.对化学平衡一定没有影响的因素是( )
A. 浓度 B温度 C压强 D.催化剂
3. 下列物质在水溶液中存在电离平衡的是( )
A. NaOH B. H2SO4 C. CH3COOH D. MgCl2
4. 下列变化中,不属于氮的固定的是( )
A.镁在空气中燃烧生成氮化镁 B.雷雨天时,大气中生成一氧化氮
C.根瘤菌使空气中的氮转化为氨D.在加压降温条件下使空气中的氮气液化
5. 向纯水中加入少量的硫酸氢钠固体(温度不变),则溶液的( )
A.PH值升高 B.酸性增强
C.水中c(H+)与c(OH-)的乘积增大 D.c(OH-)增大
6. NH4Cl溶液中水的电离程度比盐酸中水的电离程度( )
A.大 B.小 C.相等 D.不能确定
7. 在下列各给定温度和浓度的醋酸溶液中,CH3COOH的电离程度最大的是( )
A.20°C,0.1mol/L B.30°C,0.1mol/L C.20°C,0.01mol/L D.30°C,0.01mol/L
8.下列措施,一定不能加快化学反应速率的是( )
A.增大压强 B.升高温度 C.加催化剂 D.增大体积
9. 下列电离方程式中,正确的是( )
A. NH3•H2O=NH4++OH- B.KClO3=K++Cl-+3O2-
C.
H2S![]() 2H++S2- D.NaOH=Na++OH-
2H++S2- D.NaOH=Na++OH-
10. 下列有关滴定操作的顺序正确的是( )
①用标准溶液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.⑤②③①④ D.②①③⑤④
11. 强弱电解质的本质区别是( )
A.导电能力 B .相对分子质量 C、电离程度 D、溶解度
12. 用水稀释1mol/L的CH3COOH溶液时,始终保持增大的趋势的是( )
A.溶液中CH3COO- 的浓度 B.溶液中CH3COOH的浓度
C.溶液中氢离子的浓度 D.溶液中氢离子的数目
13.下列物质中,在离子方程式中,必须以离子的形式表示的是( )
A. CO2 B. CH3COOH C. AgCl D. HNO3
14. 将燃烧着的镁条插入下列气体中,镁条不能继续燃烧的是( )
A.O2 B.Cl2 C.N2 D.Ar
15. 在下列离子组中,能在强酸性溶液中大量共存,且溶液为无色透明的是( )
A.K+,Na+, CO32-,NO3- B.K+,NH4+,MnO4-,SO42-
C.Na+,K+,NO3-,HCO3- D.NH4+,Al3+,SO42-,NO3-
二、选择题(每题有1--2个正确答案,每题3分,共15分)
16.下列已达平衡状态的各反应体系,若再增大压强或升高温度,都能使平衡向正反应方向移动的是(Q>0) ( )
A. CaO(s)+CO2(g)≒CaCO3(s)-Q B.Cl2(g)+CO(g)≒COCl2(g)+Q
C.2NH3(g)≒N2(g)+3H2(g)-Q D.N2(g)+O2(g)≒2NO(g)+Q
17. 决定化学反应速率的主要因素是( )
A. 参加反应物质的性质 B.加入催化剂
C.温度和压强 D. 各反应物生成物的浓度
18. 在锌片与一定浓度的盐酸反应时,为了减缓反应速率,但不影响氢气的总量,可向盐酸中加入适量的 ( )
A.CH3COOH B.Na2CO3 C.水 D.NaOH
19. 下列离子方程式书写正确的是( )
A. 氢氧化镁和硫酸反应:Mg(OH)2+2H+=Mg2++2H2O
B. 铝跟冷的浓硝酸: 2Al+6H+=2Al3++3H2↑
C. 硫酸铝和氨水:2Al3++6NH3•H2O=2Al(OH)3↓+6NH4+
D. 铝和氢氧化钠溶液: Al+2OH-=AlO2-+H2↑
20. 下列情况对中和滴定结果无影响的是( )
A. 盛待测液的锥形瓶内有蒸馏水
B. 滴定管尖嘴部分在滴定前有气泡
C.滴定管在滴定前未将刻度调在“0”而是调在“2.40”处
D.滴定终点时,视线高于滴定管内液体凹液面的最低点
高二 化学试卷(A卷)答题卷
班级 姓名 考号
选择题答题处(每题3分,共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、填空题(14分)
21.在密闭容器中进行可逆反应: CO(气)+NO2(气)![]() CO2(气)+NO(气)+热量,达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(气)+NO(气)+热量,达到平衡后,只改变其中一个条件,对平衡的影响是:
(1)增大容器的体积,平衡 ,反应混合物的颜色 。
(2)通人CO2气体,平衡 ,反应混合物的颜色 。
(3)加入催化剂,平衡 。
22. 写出下列物质水解的离子方程式,并判断其溶液的酸碱性
NaClO ,溶液呈 性
CuSO4 ,溶液呈 性
23. 在NH4Cl溶液中,各种离子的浓度由大到小的顺序是
24. 分析外界条件的改变对电离平衡CH3COOH![]() CH3COO-+H+的影响
CH3COO-+H+的影响
| 改变条件 | 加水 | 加热 | 加浓盐酸 | 加NaOH |
| 平衡移动方向 |
四、简答题(8分)
25.现有金属铜、稀硝酸、空气、水等原料,请设计既节省原料又环保的制取硝酸铜的方案。(请用化学方程式表示,原料自选、反应条件自定)
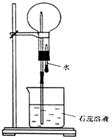 五、推断、实验题
五、推断、实验题
26.(8分)A是一种白色晶体,它与浓![]() 溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B。按右下图装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓H2SO4反应,放出无色气体HCl。用圆底烧瓶收集干燥的HCl,仍按右下图装置仪器,挤压滴管的胶头时,可以得到喷泉。
溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B。按右下图装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓H2SO4反应,放出无色气体HCl。用圆底烧瓶收集干燥的HCl,仍按右下图装置仪器,挤压滴管的胶头时,可以得到喷泉。
(1)A的化学式是______________
(2)可用于除去B中水分的干燥剂是__________。收集气体B的方法是_____ _______。
(3)收集气体HCl的方法是_____ _______。
六、计算题(10分)
27.在500℃压强为1.01×105Pa 时,将2体积SO2和1体积O2的混合气体,通入一个装有催化剂的恒容密闭容器,结果能得到含91%(体积组成)SO3的混合气体,此时容器内反应物和生成物的浓度不再发生变化。求:此时混合物中SO2和O2的体积分数各为多少?