高二化学第二学期期中考试
高 二 化 学 试 卷
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1~4页,第Ⅱ卷5~8页。全卷满分150分,考试时间120分钟。
注意事项:
1.答Ⅰ卷前,考生务必将自己的姓名、考试号、考试科目用2B铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试题卷上。
3.考试结束后,将答案卡和第Ⅱ卷一并交回。
4.答第II卷题前请务必将密封线内的项目填写清楚。
5.答第II卷时,请用钢笔或圆珠笔直接写在试题卷上。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5
第I卷(选择题 共72分)
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
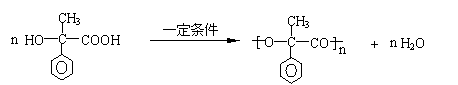
1.木糖醇是一种新型的甜味剂,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。它是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中不正确的是
A、木糖醇与葡萄糖、蔗糖等一样属于糖类
B、已知木糖醇的溶解度随着温度的升高而增大,说明木糖醇的溶解过程是一个吸热
过程
C、木糖醇易溶解于水,能发生酯化反应
D、木糖醇在口腔中不易被氧化为酸
2. 下列物质的制备需要通过酯化反应的是
①从油脂制肥皂 ②从甘油制硝化甘油 ③从纤维素制火棉
④从甲苯制TNT ⑤从淀粉制乙醇 ⑥用乙烯合成乙酸乙酯
A、只有⑥ B、只有③⑥
C、只有②③⑥ D、全部
![]()
![]()
![]() 3. 某有机物链状分子中含n个 , m个 , a个 ,其余为羟基。则羟基的个数为:
3. 某有机物链状分子中含n个 , m个 , a个 ,其余为羟基。则羟基的个数为:
A、2n+3m-a B、n+m+a C、m+2-a D、m+2n+2-a
4. 下列说法正确的是
A.酯在一定条件下的水解产物一定是酸和醇
B.凡是含有醛基的物质都能发生银镜反应,但不一定是属于醛类
C.有机物3,3—二甲基—2—丁醇发生消去反应生成两种烯烃
D.完全燃烧某有机物,生成CO2和H2O的物质的量之比为1:1,该有机物只可能是烯烃和环烷烃
5. 四氯乙烯对环境有一定的危害,干洗剂主要成分是四氯乙烯;家用不粘锅内侧涂的主要成分是聚四氟乙烯。下列关于四氯乙烯和聚四氟乙烯的叙述中正确的是
A.它们都属于纯净物
B.它们都能使酸性高锰酸钾溶液褪色
C.它们都是卤代烃
D.它们都可由乙烯只发生加成反应得到
6. 两种物质之间不可能存在的关系是
A、分子式相同,性质相同
B、最简式相同,分子式不相同
C、相对分子质量相同,分子式不相同
D、分子式相同,结构不相同
7. 分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A的可能结构有
A.1种 B.2种 C.3种 D.4种
8. 下列选项中能说明乙醇作为燃料的优点的是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量热量
A、①②③ B、①②④ C、①③④ D、②③④
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
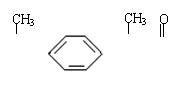 9. 某种药物主要成分X的分子结构如下,
9. 某种药物主要成分X的分子结构如下,
H3C—CH— —CH—C—O—CH3 关于有机物X的说法中,错误的是:
A.X难溶于水,易溶于有机溶剂
B.X能跟溴水反应
C.X能使酸性高锰酸钾溶液褪色
D.X的水解产物不能发生消去反应
10. 过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如SARS病毒)、细菌、真菌及芽孢。过氧乙酸可由冰醋酸与过氧化氢在一定条件下作用制得,下列有关过氧乙酸的叙述中正确的是
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸与苯酚混合使用,可增强过氧乙酸杀菌效果
C.由下列过氧乙酸的制取原理可以看出,冰醋酸被过氧化氢氧化了
O
CH3COOH+H—O—O—H—→CH3—C—O—O—H+H2O
D.浓过氧乙酸溶液中加入少许紫色石蕊试液一定呈红色
11. 现有烃的含氧衍生物A,还原A时形成醇B;氧化A时形成C。由B、C反应可生成高分子化合物![]() ,以下叙述正确的是
,以下叙述正确的是
A.A与甲醛互为同系物
B.A分子中所有原子可共平面
C.A不能使酸性高锰酸钾溶液褪色
D.1molA与足量银氨溶液反应能还原出4molAg
12. 可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是
A.氯化铁溶液、溴水
B.碳酸钠溶液、溴水
C.酸性高锰酸钾溶液、溴水
D.酸性高锰酸钾溶液、氯化铁溶液
13. 设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为![]() NA
NA
B.1 mol甲酸质量与NA个甲酸分子的质量之和相等
C.标准状况下,乙炔和氢气的混合物22.4L所含的分子数约为NA
D.1
mol碳正离子(CH![]() )所含的电子总数为8NA
)所含的电子总数为8NA
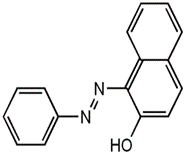 14.苏丹红一号的结构如下所示,且已知—N=N—中所有原子共平面,则下列有关说法中正确的是
14.苏丹红一号的结构如下所示,且已知—N=N—中所有原子共平面,则下列有关说法中正确的是
A.该物质的分子式为C16H12N2O
B.该物质遇FeCl3溶液呈紫色
C.该物质中所有原子不可能处于同一平面
D.该物质不能使溴水褪色
15.加拿大阿尔贡天文台在星际间发现了HC9N链状分子,其结构简式为:CH≡C-C≡C-C≡C-C≡C-C≡N,这是人类发现的最重星际有机分子,有关该分子的说法不正确的是
A.该物质属于不饱和烃
B.该分子中碳、氮原子均满足八电子稳定结构
C.该分子所有原子处在一条直线上
D.1mol该物质在一定条件下可与8molH2发生加成反应
16.研究人员最近开发出一种生物活性吸附剂,可以吸附水中的几乎全部微生物和噬菌体。这种新的吸附剂由成本低廉、环保性能好的棉纤维素和主要成分为氢氧化铝的勃姆石制造而成。下列有关说法中不正确的是
A.纤维素与核糖CH2OH(CHOH)3CHO同属糖类
B.纤维素和淀粉互为同分异构体
C.纤维素能够与醋酸发生酯化反应
D.纤维素与油脂都是天然高分子化合物,均能水解
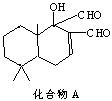 17.科学家研制出多种新型杀虫剂,以代替DDT,化合物A是其中一种。下列关于这种化合物的说法正确的是
17.科学家研制出多种新型杀虫剂,以代替DDT,化合物A是其中一种。下列关于这种化合物的说法正确的是
A、化合物A的化学式为C15H22O3
B、化合物A是芳香族化合物
C、化合物A可以发生卤代反应、酯化反应和银镜反应
D、1mol化合物A最多可与5molH2发生加成反应
![]() 18. 某有机高分子由两种结构单元 和 组成,且它们自身不能
18. 某有机高分子由两种结构单元 和 组成,且它们自身不能
相连,该有机高分子中C、H两原子物质的量之比是
A、2:1 B、3:2 C、8:5 D、19:22
 第II卷(非选择题 共78分)
第II卷(非选择题 共78分)
三、(本题包括2小题,共22分)
19.(8分)在中学化学实验中可用于分离或提纯的方法很多,如蒸馏、结晶、过滤、盐析……,下列各组混合物的分离或提纯应选用什么方法最合适,若需多步操作,请按顺序填写。
(1) 除去乙酸乙酯中混有的乙酸、乙醇_____ _______________;
(2) 除去苯中含有的少量苯酚_____ ______________________;
(3) 皂化反应后分离出肥皂______ _______________________;
(4)分离苯和硝基苯______ ____________。
20. (14分) 实验室可利用甲醇、空气和Cu制备甲醛,关于甲醇和甲醛的沸点和水溶性见下表。
| 沸点/℃ | 水溶性 | |
| 甲醇(CH3OH) | 65 | 与水混溶 |
| 甲醛(HCHO) | -21℃ | 与水混溶 |
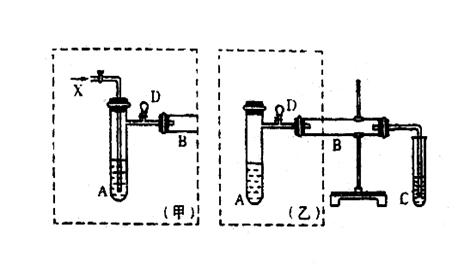 下图是两兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示,试回答:
下图是两兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示,试回答:
(1)若按甲装置进行实验,则通入A管的X是 ,
B中反应的化学方程式为 。
(2)若按乙装置进行实验,则B管中应装 ,
B中反应的化学方程式为 。
(3)试管C中装水。在仪器组装完成后,加试剂前都必须要进行的操作是
。
(4)两种装置中都需加热的仪器是 (填A、B、C),加热的方式分别为 。
(5)实验完成时先打开D处气球的铁夹,再撤去酒精灯,打开铁夹的目的是
。
(6)你认为用哪套装置较好 (填甲、乙),理由是
。
四、(本题包括2小题,共18分)
21. (10分) 烷烃A只可能有三种一氯代物B、C和D,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。相应反应如下图所示。
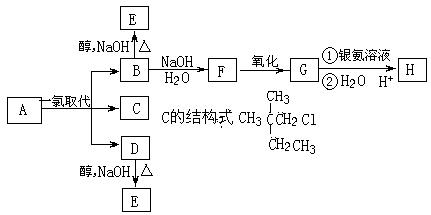
请回答:
(1)A的系统名称是 。
G的结构简式是 。
(2)B转化为F的反应类型为 。
B转化为E的反应类型为 。
(3)1.16g H与足量金属Na、Na2CO3、NaHCO3作用,标况下可得气体的体积分别为
, , 毫升。
22.(8分)山梨酸是一种不饱和脂肪酸,可参与体内正常代谢,并被氧化而生成CO2和水,可被视做食品的成分之一。山梨酸及其盐类抗菌力强、毒性小,是联合国粮农组织和世界卫生组织推荐的国际公认的广普、高效、安全的食品防腐保鲜剂。已知:
(1)山梨酸分子组成中ω(C)=0.643,ω(H)=0.071,ω(O)=0.286,且该物质的蒸气密度是相同条件下氢气密度的56倍。
(2)1L 0.1mol/L山梨酸与1L 0.1mol/L的KHCO3恰好完全反应生成标准状况下CO22.24L。
(3)山梨酸分子中所有碳原子均在同一平面内且不存在支链。
试回答:
(1)山梨酸的分子式 。
(2)山梨酸的结构简式 。
(3)写出山梨酸与乙醇反应生成酯的化学方程式
。
(4)写出体现山梨酸钾溶液呈碱性的离子方程式
。
五、(本题包括2小题,共20分)
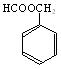
23.(8分)有机化合物CxHyOz,其相对分子质量为136,碳的质量分数是氧的质量分数的3倍。
(1)有机物CxHyOz的分子式为_________________________________。
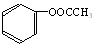
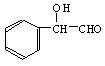
(2)若该有机物CxHyOz属于酯类,分子中含有苯环,且苯环上仅有一个侧链,则其可能的同分异构体有多种。在这些同分异构体中,若水解后得到一种羧酸和一种醇,则该有机物的结构简式可能为:__________________ ___________;若水解后得到一种羧酸和一种酚,则该有机物的结构简式可能为:_______________________________。
(3)若有机物CxHyOz不能使FeCl3溶液显色,但可被新制的氢氧化铜氧化为A,1molA跟足量金属钠反应,能生成1molH2。请写出任意一种符合这种条件的CxHyOz的结构简式:________________________________________________。
24.(12分)有机物A1和A2分别和浓H2SO4在一定温度下共热都生成烃B, B的蒸气密度是同温同压下H2密度的59倍,在催化剂存在下,1mol B可以和4molH2发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系如下:
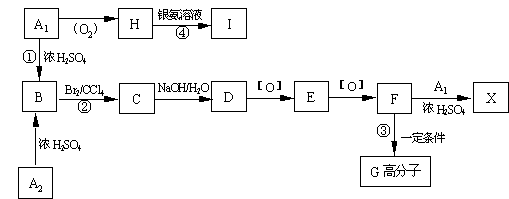
⑴ 反应①属于 反应,反应②属于 反应
⑵ 写出A2和X两种物质的结构简式:
A2 X
⑶ 书写化学方程式:
③
④
⑷化合物E 有多种同分异构体,其中属于酯类且具有两个对位侧链的同分异构体有四种,分别写出它们的结构简式:
六、(本题包括2小题,共18分)
25.(8分)在400℃、101.3kPa时,3L某烃A蒸气在mL氧气中完全燃烧,燃烧后测得气体体积为(m+6)L(气体体积均在同温同压下测定)试回答下列问题:
(1)通过计算说明,烃A的组成中应该满足的条件。
(2)通过计算推断,当m=27时烃A可能的分子式(写出常见的三种即可)。
(3)通过计算确定,若烃A在常温常压下为气体时,m的取值范围。
26.(10分)有机物A是烃或烃的含氧衍生物,分子中碳原子数不超过6。当0.1 mol A 在0.5 mol O2中充分燃烧后,A无剩余。将生成的气体(1.01×105 Pa,120 ℃)依次通过足量的无水氯化钙和足量的碱石灰,固体增重质量之比为9∶11,剩余气体的体积折算成标准状况为6.72 L。试通过计算、讨论确定A可能的化学式。
参考答案
1、A 2、C 3、C 4、B 5、C 6、A 7、B 8、D
9、B 10、AC 11、BD 12、C 13、A 14、AB 15、AD 16、BD 17、AC 18、B
19、(1)加入饱和碳酸钠溶液、分液 (2分)
(2)加入NaOH溶液、分液 (2分)
(3)加入NaCl、过滤 (2分)
![]() (4)蒸馏 (2分)
(4)蒸馏 (2分)
20、(1)空气(或氧气)(1分) 2CH3OH+O2 2HCHO+2H2O(2分)
![]() (2)CuO (1分) CH3OH+CuO
HCHO+H2O+Cu(2分)
(2)CuO (1分) CH3OH+CuO
HCHO+H2O+Cu(2分)
(3)检查装置气密性 (2分)
(4)A、B (1分) A水浴,B酒精灯加热(1分)
(5)防止倒吸(2分)
(6)甲 (1分) 制得的HCHO溶液浓度大(1分)
21、(1)A:2,2-二甲基丁烷(CH3)3CCH2CH3 (2分)
G:(CH3)3CCH2CHO (1分)
(2)B——F:取代反应 (2分) B——E:消去反应 (2分)
(3)112,112,224 毫升 (3分)
22、(1)C6H8O2(2分)
(2)CH3—CH=CH—CH=CH—COOH(2分)
![]()
(3)CH3—CH=CH—CH=CH—COOH+C2H5OH
CH3—CH=CH—CH=CH—COOC2H5+H2O (2分)
(4)CH3—CH=CH—CH=CH—COO-+H2O![]()
CH3—CH=CH—CH=CH—COOH+OH- (2分)
23、(1)C8H8O2(2分)
(2)
 | |||||
 | |||||
(2分)
(1分) (1分) ;
![]()
(3)
(邻一、间一、或对一)或 (2分)
24、⑴消去 (1分) 加成 (1分)
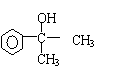
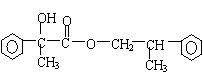 ⑵
⑵
(1分) (1分)
 ⑶
⑶
(2分)
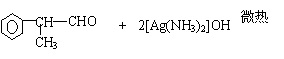 | |||
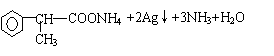 | |||
![]()

 (2分)
(2分)
⑷
(1分) (1分)
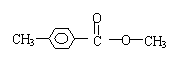 | |||
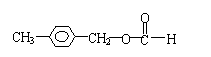 | |||
(1分) (1分)
25、(1)设烃的分子式为CxHy
![]() CxHy+(x+y/4)O2 xCO2+
CxHy+(x+y/4)O2 xCO2+![]() H2O 差量
H2O 差量
1
X+![]()
![]() —1
—1
3 (m+6)—(m—3)
列比例:1︰X+![]() =3︰[(m+6)—(m-3)] y=8 (2分)
=3︰[(m+6)—(m-3)] y=8 (2分)
(2)当m=27时,氧气恰好完全反应,也可能过量。
所以有关系: ![]() ≥
≥![]() 解之得:x≤7
解之得:x≤7
A的可能分子式:C3H8、C4H8、C5H8、C6H8、C7H8(写出其中的三个分子式就可以)
(每个1分,共3分)
(3)当A常温常压下为气体时,则x![]() ≤4 (1分)
≤4 (1分)
![]() ≥
≥![]() (1分)
(1分)
所以:m≥18 (1分)
26、(1)若剩余氧气,则由二氧化碳与水的物质的量之比,可知有机物中C、H原子个数比为1:4。(2分)
可假设有机物化学式为(CH4)mOn,列式讨论,得该有机物为CH4。(2分)
(2)若剩余气体为CO,则由有机物、氧气、一氧化碳的物质的量分别为0.1mol、0.5mol、0.3mol,可知反应中化学计量数之比。假设该有机物化学式为CXHYOZ。
![]() CXHYOZ+5O2
3CO+(x-3)CO2+
CXHYOZ+5O2
3CO+(x-3)CO2+![]() H2O
H2O
由CO2与H2O物质的量之比为1﹕2得: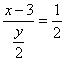 ①
①
由氧原子守恒得:Z+10=3+(2X-6)+![]() ②
共3分
②
共3分
综合①②得:Z=4X-19 (1分)
讨论知:X=5时,Z=1,有机物化学式为:C5H8O。(1分)
X=6时,Z=5,有机物化学式为:C6H12O5。(1分)