高二化学第四章《几种重要的金属》
化学试题
班级 座号 姓名 成绩
有关原子量:C-12 H-1 O-16 N-14 S-32 Al-27 Mg-24 Fe-56 Cu-64 Na-23
一、选择题(每小题只有一个正确选项,每题2分,共50分)
1、下列说法中,正确的是( )
A、 凡能导电的物质一定是单质
B、 金属单质都能与稀硫酸发生置换反应
C、活泼金属都能从盐溶液中置换出较不活泼的金属
D、在化学反应中,金属失电子,常作还原剂
2、下列性质的比较中,错误的是( )
A、熔、沸点:K>Na>Li B、原子半径:Ca>Mg>Al
C、活动性:K>Ca>Na D、氧化性:Ag+>Cu2>Mg2+
3、金属的下列性质不属于物理性质的是( )
A、反应中易失去电子 B、良的延展性
C、良好的导电传热性 D、良好的可塑性
4、要使氯化铝溶液中的Al3+完全转化成Al(OH)3,沉淀,应选用的适宜试剂是( )
A、NaOH溶液 B、稀HCl C、氨水 D、AgNO3溶液
5、工业上制造镁粉是将镁蒸气在气体中冷却。可作为却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A、①② B、②③ C、③④ D、④⑤
6、往下列物质的溶液中通入CO2气体,有白色沉淀产生的是( )
A、MgCl2 B、Al(NO3)3 C、CaCl2 D、NaAlO2
7、下列物质在常温下混合后,明显有气体放出的是( )
A、铝与浓销酸 B、铝与稀硝酸 C、镁与烧碱溶液 D、铜与稀盐酸
8、相同质量的镁条分别在①氧气、②氮气、③二氧化碳中充分燃烧,所得固体物质的质量大小排列顺序正确的是( )
A、①>②>③ B、③>②>① C、②>①>③ D、③>①>②
9、既能与强酸反应,又能与强碱反应且都放出气体的是( )
A、Al(OH)3 B、MgO C、NaHSO3 D、NH4HCO3
10、将溶液中的Mg2+、Al3+分离,可选用的试剂是( )
A、氨水 B、NaOH与HNO3 C、盐酸 D、K2CO3溶液
11、工业上冶炼金属铝的方法是( )
A.热分解法 B.热还原法 C.电解法 D.电解精炼
12、下列溶液中,能使铁粉溶解,但不会产生沉淀和气体的是( )
A、稀H2SO4 B、CuSO4溶液 C、Fe2(SO4)3 D、浓HNO3
13、能直接由金属单质与酸反应得到的盐是( )
A、Fe(NO3)3 B、CuCl2 C、FeCl3 D、AgCl
14、用一种试剂就可以将NaOH、NH4SCN、AgNO3、Na2SO4四种无色溶液一一鉴别出来,这种试剂是( )
A、溴水 B、FeCl3 C、Fe(NO3)3 D、BaCl2
15、常温下,能在铁制容器中贮存的物质是( )
A、浓盐酸 B、氯化铁溶液 C、浓硫酸 D、硫酸铜溶液
16、下列几种铁板,在镀层被破坏后,最耐腐蚀的是( )
A.镀锌铁板 B.镀铜铁板 C.镀锡铁板 D.镀铅铁板
17、下列各组离子在强酸性、无色透明溶液中能大量共存的是( )
A、K+、Fe3+、![]() 、Cu2+
B、K+、
、Cu2+
B、K+、![]() 、
、![]() 、Na+
、Na+
C、![]() 、Al3+、
、Al3+、![]() 、NO3—
D、Fe3+、
、NO3—
D、Fe3+、![]() 、Na+、S2-
、Na+、S2-
18、在相同条件下,一定量的镁、铝、铁分别投入到等体积物质的量浓度且均过量的稀硫酸中,充分反应,三溶液质量仍相等,则镁铝铁的质量关系是( )
A、相等 B、Mg>Al>Fe C、Mg<Al<Fe D、Al>Mg>Fe
19、向含1molKAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使溶液中的SO42- 恰好完全沉淀,则最后生成Al(OH)3的物质的量是( )
A、1mol B、1.33mol C、0.667mol D、0mol
20、将5.6g铁粉加入0.3mol销酸铁的溶液中,充分反应后( )
A、Fe3+全部被还原 B、Fe3+部分被还原,Fe全部被氧化
C、Fe部分被氧化 D、溶液中只有Fe2+
21、在500mLmoLL的CuSO4溶液中投入一块铁片,过一段时间后,取出铁片,洗净、干燥后称质量,铁片增加了0.8g,析出铜的质量是( )
A、0.8g B、6.4g C、7.0g D、4.8g
22、由Na、Mg、Al、Fe四种金属中的两种组成的混合物12g,与足量的盐酸反应产生氢气0.5g,则混合物中一定含有的金属是( )
A、Na B、Mg C、Al D、Fe
23、将适量的铁粉放入FeCl3溶液中,完全反应后,溶液中Fe2+和Fe3+的物质的量浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
A、2:3 B、3:2 C、1:2 D、1:1
24、在AlCl3溶液中逐滴加入过量的氨水至溶液呈碱性,下列图中,能表示该反应产生的沉淀的质量W与加入氨水的何积V关系的是( )

25、下列叙述中不正确的是( )
A.金属的电化腐蚀比化学腐蚀普遍 B.钢铁在干燥空气里不易腐烛
C.用铝质铆钉铆接铁板,铁板易被腐蚀 D.原电池中电子由正极流人负极
选择题答案卡(共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
二、填空题(共23分)
26、镁条在空气中燃烧,其反应的化学程式是 、
、 ;
27、锂电池是一种常用的电池(锂是一种碱金属元素,其相对原子量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成,电池总反应可表示为:Li+MnO2——→LiMnO2试回答:锂电池比容量特别大的原因是____ _.锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因__ ___ __.
28、含有较多Fe2+的溶液呈 色,含有较多Fe3+的溶液呈 色。往FeSO4的水溶液中滴加氨水,开始看到的现象是 ,离子方程式为 。生成的难溶物在空气中露置后,继续看到的现象是 。反应的离子方程式为 。加热上述反应最后生成的难溶物,反应的化学方程式是 。
29、铝片溶于热的烧碱溶液,反应的离子方程式为 ,该反应中氧化剂是 。向反应后的溶液农滴加入稀硫酸,最初的实验再象为 ,后来的实验现象为 ,上述现象相应反应的离子方程分别为 、
;
30、用锌片、铜片和硝酸银组成的原电池,正极上发生的电极反应是__ ____。钢铁在潮湿的空气中容易发生_____腐蚀,发生腐蚀时,正极是____,反应式为__ ___,负极反应式为____ ___。
三、推断题(共7分)
31、有A、B、C、D、E、F、G七种物质,它们的变化关系如下图所示:
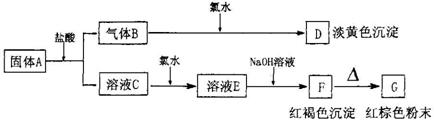
(1)写出下列物质化学式:A B E F G ;
(2)写出下列变化的化学方程式:
A→B+C: ; C→E: ;
四、实验题(共8分)
22、草酸(H2C2CO4)和浓硫酸混全缓慢加热时,可发生如下反应:
![]() 。某课外活动小组的学生设计了如下实验装置,用来制取干燥纯净的CO气体,并用生成的CO气体还原FexOy制取铁粉.
。某课外活动小组的学生设计了如下实验装置,用来制取干燥纯净的CO气体,并用生成的CO气体还原FexOy制取铁粉.
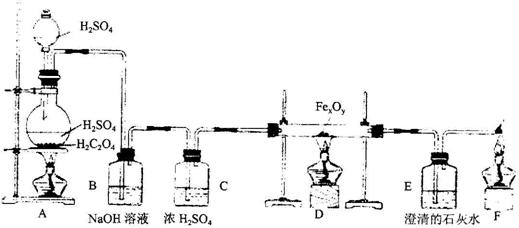 (1)装置B的作用是
,装置E中的现象是
;
(1)装置B的作用是
,装置E中的现象是
;
(2)装置C的作用是 ,装置F的作用是 ;
(3)装置D中玻璃管中发生反应的化学方程式为 ,若FexOy为0.4g,生成的气体一过量澄清石灰水反应生成0.75g白色沉淀,则FexOy的化学式为 .
五、计算题(共12分)
33、向100mL0.1mol/L的AlCl3溶液中滴加NaOH溶液,当滴加到800mL时,恰好完全反应得到澄清的溶液,求NaOH溶液的物质的量浓度。
34、在2LFe2(SO4)3和CuSO4的混合溶液中,加入30g铁粉,充分反应后得到2L0.25mol/L的FeSO4溶液及26g固体残留物。求原混合液中Fe2(SO4)3和CuSO4的物质量浓度。