高二化学会考教材中出现的化学方程式
一、卤素
(1)Cl2与金属反应,生成高价金属氯化物
2Na
+ Cl2 ![]() 2NaCl
2NaCl
2Fe
+3Cl2 ![]() 2FeCl3
(产生棕色的烟)
2FeCl3
(产生棕色的烟)
Cu
+ Cl2 ![]() CuCl2 (产生褐色的烟)
CuCl2 (产生褐色的烟)
(2)氯气的制法
Cl2的实验室制法 MnO2 +4 HCl(浓)
![]() MnCl2 +Cl2↑
+ 2H2O
MnCl2 +Cl2↑
+ 2H2O
(一部分盐酸作还原剂,另一部分酸性作用)
(3)氯化氢的制法
HCl的工业制法 H2+ Cl2
![]() 2HCl
2HCl
(氢气和氯气的混合气点燃或强光照射会爆炸;工业制盐酸,氯气在氢气中燃烧)
HCl的实验室制法 NaCl(固)
+ H2SO4(浓)
![]() NaHSO4 + HCl↑
NaHSO4 + HCl↑
(4)次氯酸的生成及不稳定性
Cl2
+H2O ![]() HCl +HClO
2HClO
HCl +HClO
2HClO![]() 2HCl +O2 ↑
2HCl +O2 ↑
(氯水中的分子:Cl2、H2O、HClO 氯水中的离子:H+、Cl-、 ClO-、OH-
HClO有:①弱酸性 ②不稳定性 ③强氧化性)
(5)Cl2的吸收 、次氯酸盐的生成
Cl2 +
2NaOH ![]() NaCl +NaClO + H2O ( 多余的氯气可以用碱溶液吸收)
NaCl +NaClO + H2O ( 多余的氯气可以用碱溶液吸收)
离子方程式:Cl2 + 2OH-![]() Cl-
+ClO- + H2O
Cl-
+ClO- + H2O
(6)漂白粉的生成、生效
2Ca(OH)2 + 2Cl2 ![]() CaCl2 + Ca(ClO)2 + 2H2O
CaCl2 + Ca(ClO)2 + 2H2O
(①工业上用氯气和消石灰反应制取漂粉精 ② 漂粉精( 漂白粉)的有效成分是次氯酸钙)
Ca(ClO)2 +H2O +CO2 ![]() CaCO3↓+
2HClO
CaCO3↓+
2HClO
(①次氯酸的酸性比碳酸弱 ②漂白粉露置在空气中会变质 ③ 漂白粉在水中与空气接触产生次氯酸,有漂白作用)
(7)F2 + H2 ![]() 2HF
2HF
2 F2
+ 2 H2O ![]() 4HF + O2 (氟气会和溶液中的水反应,生成氧气)
4HF + O2 (氟气会和溶液中的水反应,生成氧气)
(8)卤素间的置换反应
Cl2
+ 2Br-![]() 2Cl- +
Br2 Br2
+2I-
2Cl- +
Br2 Br2
+2I-![]() 2Br-
+ I2
2Br-
+ I2
(9)卤离子的检验(滴加AgNO3、稀HNO3)
Ag+ + Cl-![]() AgCl↓ (白色,不溶于酸)
AgCl↓ (白色,不溶于酸)
Ag+ +Br- ![]() Ag Br↓(淡黄色,不溶于酸)
Ag Br↓(淡黄色,不溶于酸)
Ag+
+ I - ![]() AgI↓ (黄色,不溶于酸)
AgI↓ (黄色,不溶于酸)
(10) 2 AgBr ![]() 2Ag(黑色) + Br2 (胶卷感光)
2Ag(黑色) + Br2 (胶卷感光)
二、硫
(1)硫与金属反应,生成低价金属硫化物
2 Na + S ![]() Na2S
( 白色)
Na2S
( 白色)
Fe + S ![]() FeS (黑色)
FeS (黑色)
Cu + 2S![]() Cu2S (黑色)
Cu2S (黑色)
Hg + S ![]() HgS (黑色) 用硫粉处理散落的汞滴
HgS (黑色) 用硫粉处理散落的汞滴
(2)S
+ O2 ![]() SO2 (刺激性气味,能使品红溶液褪色,具有漂白性)
SO2 (刺激性气味,能使品红溶液褪色,具有漂白性)
(3)H2S及其还原性
①H2 + S ![]() H2S (无色臭鸡蛋味气体)
H2S (无色臭鸡蛋味气体)
②还原性
2H2S + SO2 ![]() 3S + 2H2O (两气体混合有黄色粉末和水珠生成)
3S + 2H2O (两气体混合有黄色粉末和水珠生成)
2H2S + O2 ![]() 2 S↓
+2 H2O (氢硫酸在空气中久置变质)
2 S↓
+2 H2O (氢硫酸在空气中久置变质)
2H2S + O2 (不足) ![]() 2 S +2 H2O ; 2H2S +3 O2 (充足)
2 S +2 H2O ; 2H2S +3 O2 (充足) ![]() 2 SO2 +2 H2O
2 SO2 +2 H2O
(4)硫酸的工业制法
① 4FS2 +
11O2 ![]() 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
② 2SO2 + O2 2SO3
③SO3 + H2O ![]() H2SO4
(实际生产中用98.3%的浓硫酸吸收SO3,避免生成酸雾)
H2SO4
(实际生产中用98.3%的浓硫酸吸收SO3,避免生成酸雾)
( 计算关系: FeS2 ~ 2H2SO4 )
(5)浓硫酸的强氧化性
C +2H2SO4 (浓)
![]() CO2 ↑ + 2SO2 ↑ +2H2O ( 浓硫酸有强氧化性)
CO2 ↑ + 2SO2 ↑ +2H2O ( 浓硫酸有强氧化性)
Cu 2H2SO4 (浓) ![]() CuSO4 + SO2 ↑ +2H2O ( 浓硫酸有强氧化性)
CuSO4 + SO2 ↑ +2H2O ( 浓硫酸有强氧化性)
(6)SO42-检验(滴加BaCl2 和HCl或HNO3)
Ba2+ + SO42-![]() BaSO4↓( 白色,不溶于酸)
BaSO4↓( 白色,不溶于酸)
三 、碱金属
(1)2Na + 2H2O ![]() 2NaOH +H2 ↑ (浮、熔、游、响、红)
2NaOH +H2 ↑ (浮、熔、游、响、红)
(2) 4Na + O2 ![]() 2Na2O (白色固体)
2Na +O2
2Na2O (白色固体)
2Na +O2 ![]() Na2O2 (淡黄色固体)
Na2O2 (淡黄色固体)
(3)2NaCl + 2H2O ![]() 2NaOH + H2 ↑ + Cl2 ↑ (烧碱和氯气的工业制法)
2NaOH + H2 ↑ + Cl2 ↑ (烧碱和氯气的工业制法)
(4)过量CO2通入NaOH
CO2 + 2NaOH![]() Na2CO3 + H2O
Na2CO3 + H2O
Na2CO3 + H2O
+CO2 ![]() 2NaHCO3
2NaHCO3
(5)NaHCO3不稳定性
2NaHCO3![]() Na2CO3 + H2O
+CO2 ↑
Na2CO3 + H2O
+CO2 ↑
(6) NaHCO3与酸、碱反应
NaHCO3
+HCl![]() NaCl + H2O +CO2↑(离子方程式 HCO3-+H+
NaCl + H2O +CO2↑(离子方程式 HCO3-+H+ ![]() H2O
+ CO2 ↑ )
H2O
+ CO2 ↑ )
NaHCO3 + NaOH![]() Na2CO3 +H2O (离子方程式HCO3- +OH-
Na2CO3 +H2O (离子方程式HCO3- +OH-![]() H2O + CO32-)
H2O + CO32-)
四、氮族元素
(1)氮气与金属反应 3Mg + N2 ![]() Mg3N2
Mg3N2
(2)大气固氮 N2 +O2 ![]() 2NO
2NO
合成氨(人工固氮,工业制氨气) N2+ 3H2 2NH3
(3)实验室制氨气 NH4Cl + Ca(OH)2
![]() CaCl2 + NH3 ↑+H2O
CaCl2 + NH3 ↑+H2O
(4)氨气溶于水 NH3 +
H2O ![]() NH3 ·H2O
NH3 ·H2O
氨水受热分解NH3
·H2O ![]() NH3
↑ + H2O
NH3
↑ + H2O
(5)铵盐受热分解
NH4Cl
![]() NH3
↑
+ HCl↑
NH3
↑
+ HCl↑
NH3 +HCl
![]() NH4Cl (氨气和氯化氢气体向遇有白烟产生)
NH4Cl (氨气和氯化氢气体向遇有白烟产生)
NH4HCO3 ![]() NH3
↑+H2O +CO2↑(碳铵要阴天深施的原因)
NH3
↑+H2O +CO2↑(碳铵要阴天深施的原因)
(6)NH4+ +
OH- ![]() NH3
↑+ H2O ( 铵根离子的检验)
NH3
↑+ H2O ( 铵根离子的检验)
(7)硝酸的工业制法
4NH3
+ 5O2 4NO
+6 H2O
2NO + O2 ![]() 2NO2
2NO2
3NO2
+ H2O ![]() 2HNO3 + NO↑
2HNO3 + NO↑
( 计算关系: NH3 ~ HNO3 )
(8)
2NO2 (红棕色) ![]() N2O4 (无色)
N2O4 (无色)
(10)硝酸的强氧化性
Cu + 4HNO3 (浓) ![]() Cu(NO3)2 + 2NO2 ↑ + 2H2O
Cu(NO3)2 + 2NO2 ↑ + 2H2O
3Cu + 8HNO3 (稀) ![]() 3Cu(NO3)2 + 2NO ↑ + 4 H2O
3Cu(NO3)2 + 2NO ↑ + 4 H2O
C (灼热)
+
4HNO3 (浓) ![]() CO2
↑ + 2NO2 ↑ + 2H2O
CO2
↑ + 2NO2 ↑ + 2H2O
(9)硝酸不稳定性
4HNO3 ![]() 2H2O
+ 4NO2 ↑+O2
↑
2H2O
+ 4NO2 ↑+O2
↑
(10)硝酸盐热解
2 Cu(NO3)2 ![]() 2CuO + 4NO2
↑ +O2 ↑
2CuO + 4NO2
↑ +O2 ↑
2 KNO3 ![]() 2KNO2 + O2 ↑
2KNO2 + O2 ↑
五、铁和铝
(1)Fe
+ S ![]() FeS 3 Fe
+ 2O2
FeS 3 Fe
+ 2O2 ![]() Fe3O4 2Fe + 3Cl2
Fe3O4 2Fe + 3Cl2 ![]() 2 FeCl3
2 FeCl3
(2)Fe2+和 Fe3+鉴别
①Fe3+
+ 3SCN-![]() Fe (SCN)3 ( 溶液为血红色) 用KSCN溶液检验Fe3+的存在
Fe (SCN)3 ( 溶液为血红色) 用KSCN溶液检验Fe3+的存在
② Fe3+ +
3OH- ![]() Fe(OH)3↓(
红褐色) 用强碱溶液检验Fe3+的存在.
Fe(OH)3↓(
红褐色) 用强碱溶液检验Fe3+的存在.
Fe2+
+ 2OH- ![]() Fe(OH)2↓(
白色) ,
Fe(OH)2↓(
白色) ,
4 Fe(OH)2
+ O2 + 2H2O ![]() 4 Fe (OH)3 颜色变化:白→浅绿→灰绿→红褐
4 Fe (OH)3 颜色变化:白→浅绿→灰绿→红褐
(3)Fe3+盐作净水剂
Fe3+
+3H2O ![]() Fe(OH)3 (胶体)
+3 H+ (铁盐水解溶液呈酸性)
Fe(OH)3 (胶体)
+3 H+ (铁盐水解溶液呈酸性)
Fe3+ +3H2O ![]() Fe(OH)3
(胶体) +3 H+ (热水中水解为胶体溶液)
Fe(OH)3
(胶体) +3 H+ (热水中水解为胶体溶液)
(4)
2 Fe(OH)3 ![]() Fe2O3 + 3H2O ; 2 Al(OH)3
Fe2O3 + 3H2O ; 2 Al(OH)3 ![]() Al2O3 + 3H2O
Al2O3 + 3H2O
(5)Fe2O3
+ 2Al ![]() 2 Fe + Al2O3 铝粉和铁的氧化物的混合物称铝热剂
2 Fe + Al2O3 铝粉和铁的氧化物的混合物称铝热剂
(6)炼铁
炼铁的主要反应Fe2O3 + 3CO ![]() 2 Fe
+ 3CO2
2 Fe
+ 3CO2
造渣 CaCO3 ![]() CaO + CO2 ↑ ; CaO +SiO2
CaO + CO2 ↑ ; CaO +SiO2 ![]() CaSiO3
CaSiO3
(7)
4Al + 3O2 ![]() 2Al2O3
2Al2O3
(8)Al + 酸、水、碱 反应
2Al + 6H2O ![]() 2 Al (OH)3
+3H2↑( 一般情况下铝表面有紧密的氧化层保护无此反应)
2 Al (OH)3
+3H2↑( 一般情况下铝表面有紧密的氧化层保护无此反应)
2Al + 6HCl
![]() 2AlCl3 + 3H2 ↑
(2Al +
6H+
2AlCl3 + 3H2 ↑
(2Al +
6H+ ![]() 2Al3+ + 3H2↑)
2Al3+ + 3H2↑)
2Al +2H2O +2NaOH ![]() 2NaAlO2
+3H2 ↑ (2Al +2H2O +2OH-
2NaAlO2
+3H2 ↑ (2Al +2H2O +2OH-![]() 2AlO2- +3H2
↑)
2AlO2- +3H2
↑)
(9)Al2O3的两性
Al2O3 + 6HCl ![]() 2AlCl3 + 3H2
O (Al2O3 +
6H+
2AlCl3 + 3H2
O (Al2O3 +
6H+ ![]() Al3+ + 3H2O)
Al3+ + 3H2O)
Al2O3 +2NaOH![]() 2 NaAlO2 + H2O (Al2O3 +
2OH-
2 NaAlO2 + H2O (Al2O3 +
2OH-![]() 2AlO2-+
H2O)
2AlO2-+
H2O)
(10)Al(OH)3的两性
Al(OH)3 + 3HCl ![]() AlCl3 + 3H2O (Al(OH)3
+3H+
AlCl3 + 3H2O (Al(OH)3
+3H+ ![]() Al3+ + 3H2O)
Al3+ + 3H2O)
Al(OH)3 + NaOH ![]() NaAlO2 +2 H2O (Al(OH)3
+ OH-
NaAlO2 +2 H2O (Al(OH)3
+ OH- ![]() AlO2-+2
H2O)
AlO2-+2
H2O)
(11)Al3+ +3NH3 ·H2O ![]() 3NH4+ +Al(OH)3↓(不溶于弱碱,制备Al(OH)3方法)
3NH4+ +Al(OH)3↓(不溶于弱碱,制备Al(OH)3方法)
(12)Al 3+盐作净水剂
Al 3+
+3H2O ![]() Al(OH)3 +3 H+ (铝盐水解溶液呈酸性)
Al(OH)3 +3 H+ (铝盐水解溶液呈酸性)
六、有机反应
(1) 取代反应
烷烃的卤代:CH4 + Cl2 ![]() CH3Cl
+ HCl ................
CH3Cl
+ HCl ................
苯的取代 ![]() + Br2 (液溴)
+ Br2 (液溴) ![]()
![]()
![]() +HBr
+HBr
![]()
![]() + HNO3
+ H2O (又可称硝化反应)
+ HNO3
+ H2O (又可称硝化反应)
(2) 加成反应: 烯烃和氢气、溴水、卤化氢、水的加成:
CH2=CH2
+ H2 ![]() CH3CH3 CH2=CH2
+ Br2
CH3CH3 CH2=CH2
+ Br2 ![]() CH2BrCH2Br
CH2BrCH2Br
CH2=CH2
+ HCl ![]() CH3CH2Cl CH2=CH2
+H2O
CH3CH2Cl CH2=CH2
+H2O ![]() CH3CH2OH
CH3CH2OH
炔烃和氢气、溴水、卤化氢的加成
CH≡CH + 2H2 (足量) ![]() CH3CH3 CH≡CH
+ 2Br2
CH3CH3 CH≡CH
+ 2Br2 ![]() CHBr2CHBr2
CHBr2CHBr2
CH≡CH+
HCl ![]() CH2=CHCl
CH2=CHCl
苯和氢气的加成 ![]() + 3H2
+ 3H2 ![]() (环己烷)
(环己烷)
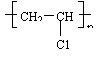
![]() (3)
聚合反应(加聚) 乙烯的聚合 n CH2=CH2
(3)
聚合反应(加聚) 乙烯的聚合 n CH2=CH2
![]()
氯乙烯的聚合n CH2=CHCl
![]()
(4) 脱水反应 分子内脱水 CH3CH2OH CH2=CH2 ↑+H2O
分子间脱水 2CH3CH2OH CH3CH2 O CH2CH3 + H2O
(5) 酯化反应 CH3COOH +CH3CH2OH CH3COOCH2CH3 + H2O