连云港市2005—2006学年度第二学期期末调研考试
高二化学试题
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试时间120分钟。
注意事项:1、答卷前,考生务必将答题纸密封线内各项用钢笔或圆珠笔填写清楚。
2、所有试题的答案均填写在答题纸上,考试结束只交答题纸。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Cl—35.5
第Ⅰ卷(选择题 共60分)
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1. “克隆”技术备受世界关注。“克隆羊”的关键技术之一是找到一些特殊的酶,这些酶能激活普通细胞使之像生殖细胞一样发育成个体。有关酶的叙述错误的是
A.酶是具有催化作用的蛋白质
B.酶的催化作用具有选择性和专一性
C.高温或重金属盐能使酶失去活性
D.酶只有在强酸或强碱条件下才能发挥作用
2.下列物质中属于天然高分子化合物的是
A.脂肪 B.棉花 C.蔗糖 D.聚乙烯
3.下列实验操作不能达到实验目的的是
①用氢氧化钠溶液除去乙酸乙酯中混有的乙酸等杂质
②用分液漏斗分离乙醇和乙酸乙酯
③用乙醇和3%的硫酸共热到170℃制乙烯
④用加入浓溴水的方法分离苯和苯酚的混合物
A.①②③④ B.①②③ C.②③ D.①④
4. 若将2-丙醇转化为1,2—丙二醇(HOCH2—CHOH—CH3),发生反应类型的顺序正确的是
A.消去―取代―加成 B.取代―消去―加成
C.消去―加成―水解 D.水解―取代―取代
5.某学生为了完成一个家庭小实验,自制烷烃的分子模型,对于CnH2n+2的烷烃,做球棍模型时,除需做3n+2个球外还需要的棍(共价键)数为
A、3n+2 B、3n+1 C、3n D、3n—1
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意)
6.社会、生活中碰到的某些问题常常涉及到化学知识,下列说法中不正确的是
A.全球禁用氟里昂是为了保护臭氧层不被破坏
B.误食重金属盐,可用喝牛奶或生鸡蛋清进行解毒
C.苯酚有毒,但它的稀溶液可直接用作防腐剂和消毒剂
D.变质的花生油有难闻的特殊气味,是由于油脂发生了水解反应
7.下列各组中的实验现象不能用相似的原理解释的是
A.葡萄糖和福尔马林与新制氢氧化铜悬浊液共热,都产生砖红色沉淀
B.将乙酸铅、硫酸铵溶液分别加入鸡蛋白溶液中,都产生白色沉淀
C.在苯、已烯中加入溴水振荡静置后,溴水层的颜色均变浅或褪去
D.乙酸钠、苯酚钠、乙醇钠溶液均能使酚酞溶液变红
8.L一多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
OH
HO ——CH2CHCOOH
NH2
这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果。下列关于L-多巴的叙述不正确的是
A.该有机物可看作氨基酸,也可看作是酚类物质
B.能与FeCl3溶液发生显色反应
C.分子中至少有7个碳原子在同一平面内
D.既能与溴水发生取代反应,又能与溴水发生加成反应
9.有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出标准状况下氢气22.4L,据此推断乙一定不是
A.HOCH2CH2OH B.HOCH2CH(OH)CH3
C.CH3CH2CH2OH D.CH3CH(OH)CH(OH)CH3
10.l,5一戊二醛(简称GA),是一种重要的饱和直链二元醛。2%的GA溶液具有广谱、高效的杀菌作用,无刺激、无腐蚀性,对禽流感、口蹄疫、猪瘟等疾病有良好的防治作用。根据上述信息,下列说法中正确的是
A.戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种
B.戊二醛能在加热条件下和新制备的氢氧化铜反应
C.戊二醛不能使酸性KMnO4溶液褪色
D.2%的GA溶液能破坏菌体蛋白质,杀死微生物
11.有4种有机物:①![]() ②
②![]() ③
③![]() ④CH3-CH=CH-CN,其中
④CH3-CH=CH-CN,其中
可用于合成结构简式为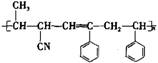 的高分子材料的正确组合为
的高分子材料的正确组合为
A.①③④ B.①②③ C.①②④ D.②③④
12.1mol 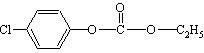 与足量的NaOH溶液混合共热,充分反应后,最多可消耗NaOH的物质的量是
与足量的NaOH溶液混合共热,充分反应后,最多可消耗NaOH的物质的量是
A.3mol B.4mol C.5mol D.6mol
13.将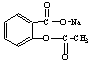 转变为
转变为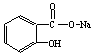 的方法正确的是
的方法正确的是
A.与足量的NaOH溶液共热后,再通入足量的CO2
B.与稀H2SO4共热后,加入足量的Na2CO3
C.与足量的NaOH溶液共热后,加入足量的稀H2SO4
D.与稀H2SO4共热后,加入足量的NaOH
14.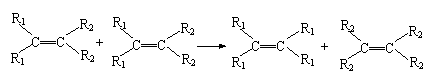 法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应(该过程可发生在不同烯烃分子间,也可发生在同种烯烃分子间)。如:
法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应(该过程可发生在不同烯烃分子间,也可发生在同种烯烃分子间)。如:
则对于有机物![]() 发生烯烃的复分解反应时,不可能生成的产物是
发生烯烃的复分解反应时,不可能生成的产物是
A.![]() B.
B.![]() C.CH2= CHCH3 D.
C.CH2= CHCH3 D.![]()
15.标准状况下,将5.6 L由CO、CH4、C2H4、C2H2组成的混合气体与18LO2混合于某密闭容器中点燃,反应完成后再恢复到原状况,得CO2气体7.50 L,则下列判断正确的是
A.反应完成后,O2有剩余
B.原混合气体中,C2H4与C2H2的体积共为1.9L
C.反应完成后,生成水的质量为9g
D.原混合气体中,CO与CH4的体积比一定为1︰1
第Ⅱ卷(非选择题 共90分)
三、(本题包括3小题,共 31 分)
16.(11分)(1)油脂属于 类,其在碱性条件下的水解反应又称 反应,产物为 (写名称)
(2)在蔗糖和麦芽糖中, 能发生银镜反应,二者 同分异构体(填“属于”或“不属于”);蔗糖的水解反应式为
(3)甲醛能使 变性凝固,所以可用其稀溶液浸制生物标本;甲醛还是非常重要的合成原料,纯净的甲醛在一定条件下加聚生成聚甲醛(是一种优良的工程塑料),聚甲醛的结构简式为 ;俄国化学家布特列洛夫在1861年首次发现在弱碱作用下,6个甲醛分子加合得到己糖,此己糖的分子式为 。
17.(8分)分子式为C3H8O的液态有机物,能与金属钠反应生成氢气,则A分子中所含官能团的名称为__ __;若该官能团位于碳链的一端,则A的结构简式为_____ _。写出(1)A与浓H2SO4共热发生消去反应的化学方程式_________ ____。
(2)A在铜作催化剂时,与氧气反应生成B的化学方程式_________ 。
(3)B与银氨溶液反应的化学方程式 。
![]() 18.(12分)某有机化合物X(C12H13O6Br)遇FeCl3溶液显紫色,其结构如下:
18.(12分)某有机化合物X(C12H13O6Br)遇FeCl3溶液显紫色,其结构如下:
BrCH2—CH2—O—C—CH2—CH—C—O—Y
(1)X在足量的NaOH水溶液中加热反应得到A、B、C三种有机物,C中只有一种氢原子。A经盐酸酸化后得到一种称之为苹果酸的物质D,2003年11月《环球时报》美国特约记者文章:一种名为苹果醋(ACV)的浓缩饮料多年来风靡美国,其中的主要酸性物质就是苹果酸。 写出A、B、C、D的结构简式:
A B C D
(2)写出与D属于同类的同分异构体的结构简式
(3)两分子D通过分子间脱水可形成 种环状酯,试写出其中生成六元环状酯的化学方程式 。
(4)C经酸化后可得到E,写出E与足量浓溴水反应的化学方程式
四、(本题包括2小题,共24分)
19.(8分)以下实验操作及结论正确的是 (填编号)。
(1)实验室制乙烯时,将温度计的水银球插入反应液中;而石油分馏时,温度计的水银球应置于蒸馏烧瓶的支管口处。
(2)在溴乙烷中加入烧碱溶液,充分振荡静置后,取上层清夜,再滴加硝酸银溶液,以检验水解生成的溴离子。
(3)做过银镜反应的试管用稀硝酸洗涤。
(4)淀粉中加入稀硫酸,加热一段时间后,用NaOH中和水解液,再加入银氨溶液,稍加热,若有银镜出现,说明淀粉已完全水解。
(5)向2 mL 2%硝酸银溶液中滴加稀氨水(边滴加边摇动)至产生的沉淀恰好溶解即得银氨溶液。
(6)用酸性高锰酸钾溶液和溴水能鉴别己烯、甲苯、乙酸乙酯、苯酚溶液。
20.(16分)某课外小组设计的实验室制取乙酸乙酯的装置如图所示。 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物的沸点如下表:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
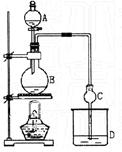 A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液。经分液漏斗边滴加醋酸、边加热。
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液。经分液漏斗边滴加醋酸、边加热。
请回答:
(1)反应中加入的乙醇是过量的,其目的是_________________;
(2)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为 。
(3)球形干燥管C的作用是______________________________。
若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)_______________________;反应结束后D中的现象是____________________________。
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出_______________;再加入(此空从下列选项中选择)______ ___,
目的是 ,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰
五、(本题包括2小题,共20分)
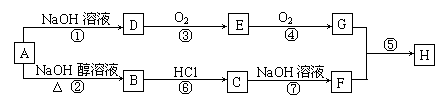 21.(10分)已知连接羟基的碳原子上没有氢原子的醇不能发生催化氧化反应。A是一种重要的化工原料,其分子组成为C4H9Cl,A有如下转化关系(部分反应条件已略去):
21.(10分)已知连接羟基的碳原子上没有氢原子的醇不能发生催化氧化反应。A是一种重要的化工原料,其分子组成为C4H9Cl,A有如下转化关系(部分反应条件已略去):
其中F不能发生催化氧化反应,E和G都能和新制Cu(OH)2反应,但反应条件及实验现象均不相同,H是一种有果香味的液体。
(1)A的同分异构体有 种,符合上述条件的A结构简式为 。
(2)与①、⑦反应类型相同的是_______(填序号),若A中混有C,则对生成的B的纯度是否有影响___ ___(填“有”或“无”)。
(3)写出下列反应的化学方程式:A→B:__________________________;
E与新制Cu(OH)2反应:_______________________________________________;
22.(10分)法国化学家V.Grignard,所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成。Grignard试剂的合成方法是:RX+Mg![]() RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
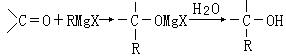
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种。
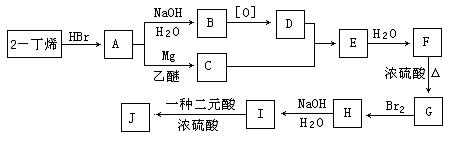
请按要求填空:
(1)F、H的结构简式分别是 , ;
(2)C+D→E的反应类型是 ,H→I的反应类型是 ;
(3)写出下列化学反应方程式:A→B ,I→J
六、(本题包括2小题,共15分)
23.(6分)某饱和一元羧酸和饱和一元醇所生成的酯A 1.48g与30mL 1mol/L的NaOH溶液在加热下反应,待反应完全后,反应后的混合物中剩余的NaOH需用40mL 0.25mol/L盐酸才能刚好中和。
(1)求A的分子式;
(2)写出A可能的结构简式。
24.(9分)乙炔和乙烷的混合气体共amol,与bmol的氧气共存于一密闭容器中,点燃后充分反应,乙炔和乙烷全部消耗完, 得到CO和CO2的混合气体和36g的水。求:
(1)当a=1时,乙炔和乙烷的物质的量;
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前氧气的4/5时,求b的值和此时生成CO和CO2的物质的量的比值;
(3)a、b的取值范围。
连云港市2005—2006学年度第二学期期末考试
高二化学试题参考答案及评分标准(06.6.)
一、选择题(1—5题,每小题只有一个选项符合题意,每小题4分,共20分)
二、选择题(6—15题,每小题有1—2个选项符合题意,每小题4分,共40分。只有一个正确选项的,多选不给分;有两个正确选项的,只选一个且正确的给2分,选错一个该小题不给分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | D | B | A | C | B | D | BC | D | CD | BD | D | C | A | C | AB |
三、(共31分)
|
![]() (2)麦芽糖 属于 C12H22O11+ H2O C6H12O6 + C6H12O6
(4分)
(2)麦芽糖 属于 C12H22O11+ H2O C6H12O6 + C6H12O6
(4分)
葡萄糖 果糖
![]()
![]() (3)蛋白质 [
CH2—O]n C6H12O6 (3分)
(3)蛋白质 [
CH2—O]n C6H12O6 (3分)
17.(8分)羟基 CH3CH2CH2OH (2分)
(1)CH3CH2CH2OH浓H2SO4ΔCH3CH=CH2↑+H2O
|
![]() (3)CH3CH2CHO+2Ag(NH3)2OH CH3CH2COONH4+2Ag↓+ 3NH3 + H2O
(3)CH3CH2CHO+2Ag(NH3)2OH CH3CH2COONH4+2Ag↓+ 3NH3 + H2O
![]() (方程式每个2分)
(方程式每个2分)
![]()
|
|
|
|
| |||
![]()
![]()
![]()
![]() (3)3(2分) 2HOOCCH2CHCOOH
HOOCCH2CH—C O + 2H2O
(3)3(2分) 2HOOCCH2CHCOOH
HOOCCH2CH—C O + 2H2O
![]()
![]() O O (2分)
O O (2分)
![]() O C — CHCH2COOH
O C — CHCH2COOH
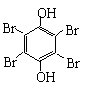
 (4)
(4)
![]() + 4Br2
↓ +
4HBr
(2分)
+ 4Br2
↓ +
4HBr
(2分)
四、(共24分)
19.(8分)(1)、(3)、(5)、(6)
|
(2)CH3COOH + CH3CH218OH ![]() CH3CO18OCH2CH3
+ H2O
CH3CO18OCH2CH3
+ H2O
(3)冷凝、防倒吸 CO32-+H2O
![]() HCO3-+OH-
HCO3-+OH-
溶液分层,上层为无色油状液体,下层溶液颜色由红色变为无色(或变浅)
(4)乙醇 C(无水硫酸钠) 除水 (每空2分)
五、(共20分)
![]()
|
|
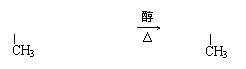 |
|
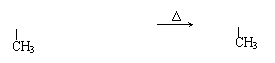
|
 (2分)
(2分)
22.(10分)(1)CH3CH2—C — CH—CH2CH3 CH3CH2—C — C—CH2CH3 (4分)
|
|
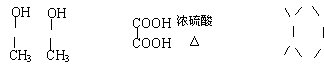 |
CH3CH2C — C—CH2CH3 + ![]() + 2H2O
+ 2H2O
(2分)
六、(共15分)
23.(6分) n(酯)= 0.03L×1mol/L-0.04L×0.25mol/L==O.O2mol (1分)
M(酯)== 1.48g/0.02mol=74g/mol (1分)
分子式为:C3H6O2 (2分)
A的可能结构为:HCOOCH2CH3,CH3COOCH3 (2分)
24.(9分) (1)n(H2O)=2mol
由H原子守恒可得乙炔和乙烷的物质的量各为0.5mol (2分)
(2)由C原子守恒可得:4/5b = 1mol×2 b=2.5mol (1分)
n(CO)+ n(CO2) = 2mol (C原子守恒)
n(CO)+2n(CO2)+ n(H2O)= 2.5mol×2 (O原子守恒)
得: n(CO)=1mol n(CO2)=1 mo l n(CO): n(CO2)=1:1 (2分)
(3)由极端假设可得取值范围为2/3〈 a〈2 (2分)
5/3〈 b〈 5 (2分)
答:略。(其他合理解法均得分)