高二第一学期期末化学试卷(附答案)
命题 钱承之 审核 陈雪泥 考试时间 120分钟 共8页
可能用到的相对原子质量:
Ar(Cu)=64 Ar(Al)=27 Ar(Fe)=56 Ar(Mg)=24 Ar(K)=39 Ar(H)=1 Ar(O)=16
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
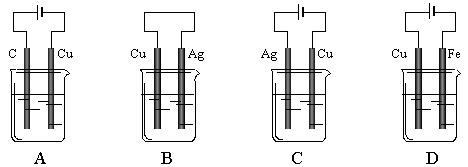
1.将铁片投入到下列溶液中,不放出气体且“铁片”质量减少的是
A. CuSO4溶液 B. H2SO4溶液
C. AgNO3溶液 D. FeCl3溶液
2.下列各离子方程式中,属于水解反应的是
A.H2O+H2O![]() H3O++OH- .
H3O++OH- .
B.HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
C.HS-+H2O![]() S2-+H3O+
S2-+H3O+
D.H2CO3![]() HCO3-+H+
HCO3-+H+
3.铜制品上的铝质铆钉,在潮湿空气中易腐蚀的原因可描述为
A.形成原电池时,铝作负极
B.形成原电池时,铜作负极
C.形成原电池时,电流是由铝经导线流向铜
D.铝铆钉发生了化学腐蚀
4.在一定条件下,可逆反应X(g)+2Y(g)![]() 2Z(g)达到平衡时,测得Y的转化率为20%,X的转化率为50%,则反应开始时,充入容器中X和Y物质的量之比为
2Z(g)达到平衡时,测得Y的转化率为20%,X的转化率为50%,则反应开始时,充入容器中X和Y物质的量之比为
A.1∶5 B.1∶4 C.1∶3 D.1∶2
5.某无色溶液pH=1,投入铝片有氢气放出,则溶液中下列各组离子能大量共存的是
A.NH4+、Al3+、SO42—、Br— B.K+、Na+、Cl—、NO3—
C.Mg2+、Na+、OH-、Cl— D.K+、NH4+、SO42—、HCO3—
6.在含0.01mol的明矾[KAl(SO4)2·12H2O]的溶液中逐滴加入含有0.02mol的Ba(OH)2溶液,下列判断正确的是
A、先出现沉淀,后来全部溶解
B、最终得到的沉淀只有硫酸钡
C、当Al3+、SO42-全部沉淀时,得到的沉淀质量最大
D、当SO42-完全沉淀时,得到的沉淀物质的量最大
7.反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
A.v(NH3)=0.010 mol·L-1·s-1 B.v(O2)=0.0010 mol·L-1·s-1
C.v(NO)=0.0010 mol·L-1·s-1 D.v(H2O)=0.045 mol·L-1·s-1
8.下列离子方程式正确的是
A.氢碘酸和硝酸银溶液的反应:HI+Ag+=AgI↓+H+
B.氨气通入氢氟酸溶液中:NH3+H+=NH4+
C.向碳酸氢镁溶液中加入过量烧碱:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
D.向NaAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
二、选择题(本题包括10小题,第9~16小题每小题4分,第17、18小题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个,该小题就为0分。)
9.曾在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O。以下叙述正确的是
A.铝热剂就是单指Fe2O3粉和铝粉的混合物
B.检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品——粉碎——加水溶解——过滤——向滤液中滴加KSCN溶液
C.分别还原amol Fe2O3所需H2、Al、CO物质的量之比为3∶2∶3
D.明矾属硫酸盐,是纯净物
10.现将V1 L pH=10的NaOH溶液和V2 L pH=5的H2SO4溶液混合,得(V1+V2)L pH=8的溶液,那么V1∶V2为:
A.1∶9 B.2∶11 C.1∶4 D.11∶2
11.下列各组数据中前者比后者大的是
A.pH=10的K2CO3溶液和pH=10的KOH溶液中由水电离出的OH-离子浓度
B.0.1mol·L-1的CH3COOH溶液与1.0mol·L-1的CH3COOH溶液中c(H+)
C.Na2CO3溶液的HCO3—和OH-的数目
D.纯水在20℃和100℃时的pH
12.下列物质中的一氯代烷有三种的是
A.正己烷 B.2-甲基戊烷
C.2,2-二甲基丁烷 D.2,3-二甲基丁烷
13.一定条件下,在一个体积可变的容器中有如下平衡体系:
2SO3(g)![]() 2SO2(g)+O2(g),△H<0。
2SO2(g)+O2(g),△H<0。
在t1时改变某个条件,在t2时达成新的平衡。下列关于t1时改变条件的说法正确的是

A.温度不变,扩大容器的体积
B.压强、温度不变,充入一些N2(g)
C.压强不变,降低温度
D.温度、压强不变,充入一些SO3(g)
14.下列各对物质中属于同分异构体的是
A.![]() C与
C与![]() C
B.O2与O3
C
B.O2与O3
C.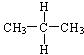 与
与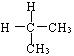 D.
D.![]() 与
与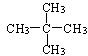
15.在Al2(SO4)3和MgSO4混合溶液中,滴加NaOH溶液,生成沉淀物质的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4物质的量之比为
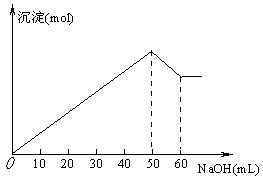
A.6∶1 B.1∶2
C.2∶1 D.3∶1
16.某同学为了完成H2SO4+Cu=CuSO4+H2↑的反应,设计了下列四个实验,如图所示,你认为可行的方案是(电解质溶液为H2SO4,忽略溶液中溶解的氧气)
17.将0.2mol·L-1的CH3COOH溶液和0.1mol·L-1的KOH溶液等体积混合后,溶液呈酸性。溶液中离子浓度关系正确的是
A.c (CH3COOH)+c(CH3COO-)=0.2mol·L-1
B.c(K+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(K+)>c(H+)>c(OH-)
D.c(CH3COOH)+c(H+)=c(OH-)+0.05mol·L-1
18. Na2O2、HCl、Al2O3三种物质溶于水中,完全反应后,测得所得溶液中只含有Na+、Cl-、AlO2-(不考虑AlO2-的水解),则Na2O2、HCl、Al2O3的物质的量之比为
A.4∶6∶1 B.8∶6∶1 C.3∶3∶1 D.2∶2∶1
第Ⅱ卷(选择题 共76分)
三、(本题包括2小题,共20分)
19.(8分)(1)CH3COOH溶液中的c(OH-)变大,可采取的措施是_______________。
①升高溶液温度 ②加水稀释 ③加少量CH3COONa晶体 ④加入少量锌粉
(2)向MgCl2溶液中加入浓氨水有白色沉淀生成,离子方程式是 _______;若在Mg(OH)2的悬浊液中加入CH3COONH4或NH4Cl固体,经搅拌白色沉淀慢慢溶解,其原因是(用平衡移动原理解释)_____________________________________________。
20.(12分)如图所示:甲、乙为相互串联的两电解池。试回答:
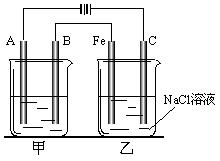
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为_____极,电极材料是_________,电极反应式为________,电解质溶液可以是______________。
(2)乙池中Fe极电极反应式为_______________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈____________色。
(3)若甲池A极增重12.8g,则乙池C(石墨)极放出气体在标况下的体积为__________。
(4)电解后,若乙池剩余溶液为400mL,则溶液的pH=___________。
四、(本题包括2小题,共18分)
21.(6分)分子组成为C8H18的烃,当主链有5个碳原子时,其可能的结构简式是:
___________________________________________________________________________
___________________________________________________________________________
22.(12分)如图,A、B各为溶有一种物质的水溶液,A溶液无色,A的稀溶液常用于伤口的消毒,B溶液浅绿色。D、E均为无色气体,G是不溶于稀硝酸的白色固体。若不计反应中的损失,E和G的物质的量相等。图中某些反应的部分产物已略去。
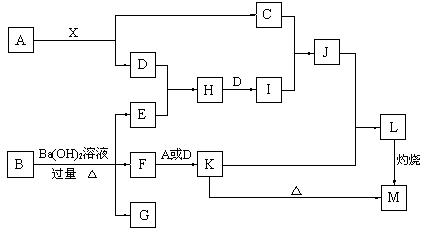
(1)已知X是黑色粉末,A溶液中溶质的电子式是________________。
(2)用离子方程式表示L溶液为什么显酸性_______________________________________。
(3)F和A溶液反应的化学方程式______________________________________________。
(4)H是一种大气污染物,在排放前,使E和H在催化剂的作用下直接反应从而消除污染,反应的化学方程式为________________________________________________。
(5)B溶液中溶质的化学式是________________,M的化学式是_________________。
五、(本题包括2小题,共18分)
23.(12分)(1)向一试管用排空气法充入一定量无色气体后进行如下图的实验:

向试管中充入的气体是 (填化学式),滴入的指示剂是 。用电离方程表示最后溶液呈红色的原因 _____________________。
(2)要分离由碳酸钡、氯化镁、氯化铝组成的混合物,第一步应加入 ,分离出 ;第二步再加入 ,即可使其余两种物质分离开来。若要使后两种物质恢复为原来的物质,还需加入 ,其反应的离子方程是 和 。
24.(6分)(1)下图分别表示盛有液体的量筒、滴定管的一部分,下述读数及说法正确的是(填编号)___________。
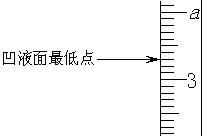
①若是量筒,a=2,读数为2.7mL
②若是量筒,a=4,读数为3.30mL
③若是滴定管,a=2,读数为2.70mL
④若是滴定管,a=4,读数为3.30mL
(2)在酸碱中和滴定过程中(把标准液放在滴定管中),对于以下操作不当引起的误差,其中偏大的为__________(填序号)。
①滴定管用蒸馏水洗净后,未用已知浓度的溶液润洗;
②锥形瓶用蒸馏水冲洗后,又用待测液润洗;
③滴定管滴定前有气泡,滴定终无气泡;
④滴定前平视,滴定终了俯视;
⑤滴定前仰视,滴定终了平视。
六、(本题共2小题,共20分)
25.(10分)已知T℃、PkPa时,在容积为V的密闭容器内充有1molA和1molB。保持恒温恒压,使反应:A(g)+B(g)![]() C(g)达到平衡时,C的体积分数为40%。试回答下列问题:
C(g)达到平衡时,C的体积分数为40%。试回答下列问题:
(1)欲使温度和压强在上述条件下恒定不变,在容器内充入2molA和2molB,则反应达平衡时,容器的容积为 ,C的体积分数为 。
(2)若另选一容积固定不变的密闭容器,仍控制温度为T℃,使1molA和1molB反应达到平衡状态时,C的体积分数仍为40%,则该容器的容积为 。
26.(10分)用0.1mol·L-1HCl滴定含KOH的不纯样品(杂质不与HCl反应),称取样品0.5g,配制成40mL溶液。用HCl滴至完全中和时,用去HCl A毫升。若已知当加入![]() mLHCl,溶液的pH=13,求KOH的纯度。
mLHCl,溶液的pH=13,求KOH的纯度。
参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| D | B | A | A | A | B | C | C |
二、选择题
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| CD | A | AD | AC | D | D | B | D | CD | AD |
三、
19.(1)②③④ (2)Mg2++2NH3·H2O=Mg(OH)2↓+NH4+;Mg(OH)2悬浊液中存在着下列平衡:Mg(OH)2![]() Mg2++2OH-,当加入NH4+时,NH4+结合OH-,使c(OH-)降低,平衡右移,Mg(OH)2逐渐溶解。
Mg2++2OH-,当加入NH4+时,NH4+结合OH-,使c(OH-)降低,平衡右移,Mg(OH)2逐渐溶解。
20.(1)阴极 精铜 Cu2++2e-=Cu CuSO4 (2)2H++2e-=H2↑ 红 (3)4.48L
(4)14
四、
21.
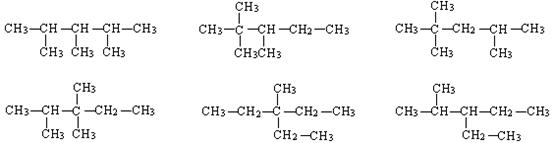
|
(4)4NH3+6NO![]() 5N2+6H2O (5)(NH4)2Fe(SO4)2 Fe2O3
5N2+6H2O (5)(NH4)2Fe(SO4)2 Fe2O3
五、
23.(1)NH3 酚酞 NH3·H2O![]() NH4++OH- (2)H2O BaCO3 NaOH溶液 盐酸 Mg(OH)2+2H+=Mg2++2H2O
AlO2-+4H+=Al3++2H2O
NH4++OH- (2)H2O BaCO3 NaOH溶液 盐酸 Mg(OH)2+2H+=Mg2++2H2O
AlO2-+4H+=Al3++2H2O
24.(1)③ (2)①②③
六、
25.(1)![]() ,40% (2)
,40% (2)![]()
26.完全中和时,n(KOH)=n(HCl),∴40c(KOH)=0.1A A=400c(KOH)……①
当加入![]() HCl时,c(OH-)=
HCl时,c(OH-)=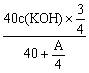 =0.1 (pH=13)………………②
=0.1 (pH=13)………………②
解①、②得:c(KOH)=0.2mol·L-1 m(KOH)=0.2×0.04×56=0.448(g)
ω(KOH)=![]() (或90%)
(或90%)