综合测试试卷
【模拟试题】
全卷可能用到的相对原子质量:
H:1 C:12 O:16 Cl:35.5 Na:23 Fe:56 Cu:64
一. 选择题(本题包括10小题,每小题2分,共20分)每小题只有一个选项符合题意。
1. 下列物质中属于离子化合物的是
A. 苛性钾 B. 碘化氢 C. 硫酸 D. 醋酸
2. 下列物质中不会因见光而分解的是
A. NaHCO3 B. HNO3 C. AgI D. HClO
3. 以NA表示阿佛加德罗常数,下列说法中正确的是
A. 53g碳酸钠中含NA个CO32-
B. 0.1molOH-含NA个电子
C. 1.8g重水(D2O)中含NA个中子
D. 标准状况下11.2L臭氧中含NA个氧原子
4. 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A. 稀硝酸 B. 稀盐酸 C. 硝酸铜 D. 氢氧化钠
5. 相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A.
NH4Cl
B. NH4HCO3 C. NH4HSO4 D. ![]()
6. 分子为C4H9Cl的同分异构体有
A. 1种 B. 2种 C. 3种 D. 4种
7. 以下说法正确的是
A. 纳米材料是指一种称为“纳米”的新物质制成的材料
B. 绿色食品是指不含任何化学物质的食品
C. 生物固氮是指植物通过叶面直接吸收空气中的氮气
D. 光导纤维是以二氧化硅为主要原料制成的
8. 在pH=1的无色溶液中能大量共存的离子组是
A. NH4+、Mg2+、SO42-、Cl- B. Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl- D. Na+、Ca2+、Cl-、AlO2-
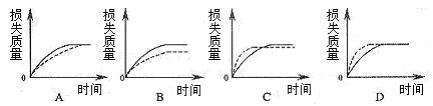
9. 将Ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将质量不同的Bg粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是
10. 可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是
A. 氯化铁溶液、溴水 B. 碳酸钠溶液、溴水
C. 酸性高锰酸钾溶液、溴水 D. 酸性高锰酸钾溶液、氯化铁溶液
二. 选择题(本题包括10小题,每小题2分,共20分)每小题有一个或两个选项符合题意。若正确答案只有一个选项,多选时,这题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要错选一个,这小题就为0分。
11. 下列各项中表达正确的是
A. ![]() 的结构示意图:
的结构示意图: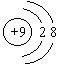 B. CO2的分子模型示意图:
B. CO2的分子模型示意图:![]()
C.
NaCl的电子式:![]() D.
N2的结构式::N≡N:
D.
N2的结构式::N≡N:
12. 下列说法不正确的是
A. 蔗糖不是淀粉水解的产物
B. 蔗糖的水解产物能发生银镜反应
C. 蔗糖是多羟基的醛类化合物
D. 蔗糖与麦芽糖互为同分异构体
13. 下列叙述正确的是
A. 同周期非金属元素的原子半径越小,其单质的沸点越高
B. 同周期元素的离子,核电荷数越大半径越大
C. 同周期主族元素的原子半径越大,其原子越易失去电子
D. 同周期非金属元素的原子半径越大,其气态氢化物越稳定
14. 天然维生素P(结构如下图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
A. 可以和溴水反应
B. 可用有机溶剂萃取
C. 分子中有三个苯环
D. 1mol维生素P可以和4molNaOH反应

15. 下列离子方程式中正确的是
A. 过量的NaHSO4与![]() 溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B. NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C. 苯酚钠溶液中通入少量CO2:![]() -O-+CO2+H2O→
-O-+CO2+H2O→![]() -OH+HCO3-
-OH+HCO3-
D. FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
16. 为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A. ![]() 溶液(
溶液(![]() ) B.
) B. ![]() 溶液(
溶液(![]() )
)
C. ![]() (淀粉溶液) D.
(淀粉溶液) D. ![]() 溶液(石蕊试液)
溶液(石蕊试液)
17. 近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是
A. 由二氧化碳合成金刚石是化学变化
B. 金刚石是碳的一种同位素
C. 钠被氧化最终生成碳酸钠
D. 金刚石中只含有非极性共价键
18. 在10mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是
A. c(Na+)>c(Ac-)>c(H+)>c(OH-)
B. c(Na+)>c(Ac-)>c(OH-)>c(H+)
C. c(Na+)=c(Ac-)>c(HAc)
D. c(Na+)+c(H+)=c(Ac-)+c(OH-)
19. CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
A. 将两种样品分别溶于硝酸,区别所产生的气体
B. 将两种样品分别溶于硝酸,区别溶液的颜色
C. 取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D. 取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
20. 混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是
A. 向CuSO4溶液中加入适量铁粉
B. 等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C. 等物质的量的NaHCO3与Na2O2固体
D. 在NaBr溶液中通入过量氯气
三. 填空题:(本题包括2小题,共8分)
21.(5分)实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg = Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
Cu2++ I- = CuI+ I3-
22.(3分)现有可逆反应A(气)+B(气)![]() 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混物中的百分含量(C%)和反应时间(t)的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混物中的百分含量(C%)和反应时间(t)的关系:
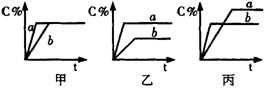
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则______曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是______热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则_______曲线是表示压强较大的情况。
23.(8分)人们对苯的认识有一个不断深化的过程。
(1)1834年德国科学家米希尔里希,通过蒸馏安息香酸(![]() -COOH)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式
-COOH)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式
(2)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种含叁键且无支链链烃的结构简式 。
苯不能使溴水褪色,性质类似烷烃,任写一个苯发生取代反应的化学方程式
(3)烷烃中脱水2 mol氢原子形成1 mol双键要吸热,但1,3-环己二烯(![]() )脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯
(填稳定或不稳定)。
)脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯
(填稳定或不稳定)。
(4)1866年凯库勒(图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列 事实(填入编号)
a. 苯不能使溴水褪色 b. 苯能与H2发生加成反应
c. 溴苯没有同分异构体 d. 邻二溴苯只有一种

(5)现代化学认为苯分子碳碳之间的键是 。
四. 推断题:(本题包括2小题,共20分)
24.(6分)已知:①A、B、C、D四种物质均含元素X.有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。② X在A、B、C、D中都不呈现它的最高化合价。③室温下单质A与某种常见一元强碱溶液反应.可得到B和C。④ 化合物D受热催化分解。可制得元素Y的单质。
(1)元素X是____________________。Z是__________________。
(2)写出③中反应的化学方程式____________________。
(3)写出④中反应的化学方程式____________________。
25.(5分)下图![]() 分别代表有关反应中的一种物质,请填下以下空白。
分别代表有关反应中的一种物质,请填下以下空白。
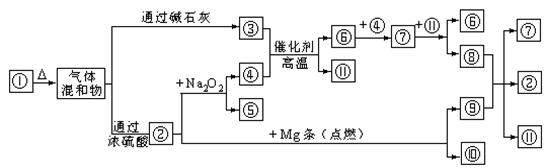
(1)①、③、④的化学式分别是 、 、 。
(2)⑧与⑨反应的化学方程式是 。
26.(12分)如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6), B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F。已知,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之,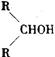 最难。
最难。
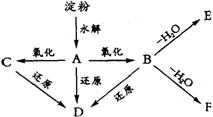
请在下列空格中填写A、B、C、D、E、F的结构简式。
A: B: C:
D: E: F:
27.(7分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。

请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
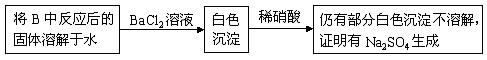
上述方案是否合理?
请简要说明两点理由:① ; ② 。
五. 实验题:(本题8分)
28. 制取氨气并完成喷泉实验(图中夹持装置均已略去)。
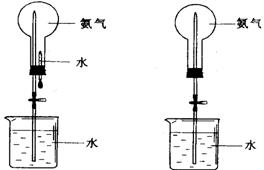
图1 图2
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
答: 。
六. 计算题:(本题7分)
29. 用20mLFeCl3溶液腐蚀3.2gCu片,将Cu片完全腐蚀后,加入铁粉2.8g,反应后溶液中存在不溶物1.6g(设反应前后溶液体积变化忽略不计)。计算:
(1)20mL这种溶液中的FeCl3 与多少mL 5mol/L 的FeCl3 溶液中所含FeCl3 的物质的量相等?
(2)反应后溶液中Fe2+的物质的量浓度为多少?
【试题答案】
一、二. 选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | A | B | C | C | D | D | A | C | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | C | C | C | AC | A | B | AC | C | BD |
三. 填空题
21.(1) +1 (2) CuI 0.5 (3) 2 5 2 1
22.(1) a (2) 吸 (3) b
23.(1)![]() -COONa+NaOH
-COONa+NaOH![]()
![]() +Na2CO3
+Na2CO3
(2)HC≡C-C≡C-CH2-CH3
![]() +Br2
+Br2![]()
![]() -Br+HBr(或其它合理答案)
-Br+HBr(或其它合理答案)
(3)稳定
(4)a d
(5)介于单键和双键之间的特殊的键(或其它合理答案)
四. 推断题
24.
(1)Cl(或氯) K(或钾)
(2)Cl2+2KOH===KCl+KClO+H2O
(3)![]()
该题为典型的推断题.解答推断题的关键是寻找突破口.此题的突破口是:室温下单质A与某种常见一元强碱溶液反应.可得到B和C.且A、B、C中都含有X.说明A与碱发生了歧化反应.常温下能与碱溶液发生歧化反应的在中学化学中主要是Cl2、Br2等.这就缩小了思考的范围.再结合其他条件从而找出答案.
25.(1)NH4HCO3 NH3 O2 (2)C+4HNO3 = 2H2O+4NO2+CO2
26.
A. HOCH2(CHOH)4CHO B. HOCH2(CHOH)4COOH
C. HOOC(CHOH)4COOH D. HOCH2(CHOH)4CH2OH
E.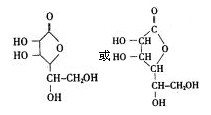
F. 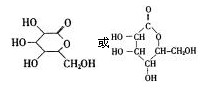
五. 实验题
27.
(1)![]()
(2)取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。
(3)不合理。① 稀硝酸能将亚硫酸钡氧化为硫酸钡 ② 如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根。
解析:SO2与Na2O2反应原理区别于CO2与Na2O2反应,因SO2有较强的还原性,能被强氧化剂Na2O2氧化成Na2SO4,结合O2、![]() 、
、![]() 离子的检验即可解答。本题以SO2与Na2O2反应的探究性实验为载体,考查了学生的科学思维方法的素质与学生的实验能力、综合能力,较好的贯彻和体现了考纲的要求,有利于高校选拔人才。
离子的检验即可解答。本题以SO2与Na2O2反应的探究性实验为载体,考查了学生的科学思维方法的素质与学生的实验能力、综合能力,较好的贯彻和体现了考纲的要求,有利于高校选拔人才。
28.
(1)![]()
(2)向下排空气 碱石灰
(3)打开止水夹,挤出胶头滴管中的水。
氨气极易溶解于水,致使烧瓶内气体压强迅速减小。
(4)打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
六. 计算题
29. 解:(1)30.0mL(2)10mol/L
“你不是说你的心胸很宽阔吗?可是,为什么人家只是说你两句,你就生这么大的气,就像被丢了颗小石头的水盆,水花到处飞溅?”