吉 安 市 高 二 下 学 期 期 末 检 测
化 学 试 卷
(测试时间:100分钟,卷面总分:100分)
命题:安福中学 王迅强 泰和二中 周江平
审校:吉安市教研室 曹发根
可能用到的相对原子质量:H 1, C 12, O 16, Br 80
第I卷(选择题,共45分)
请将本卷答案写在第II卷卷首的答题栏中。
一、 选择题(本题包括15小题,每题3分,每小题只有一个选项符合题意)
1、下列试剂的储存方法正确的是 ( )
A.浓硝酸存放在棕色广口试剂瓶中 B.少量白磷存放在煤油中
C.盛液溴的试剂瓶里加少量水以减少溴的挥发
D.将浓氨水和浓盐酸存放在同一药品橱里
2、将pH试纸用蒸馏水湿润后去测定稀H2SO4的pH,所测pH会 ( )
A.偏高 B.偏低 C.不变 D.无法预测
3、对可逆反应4NH3(g) +
5O2 (g)![]() 4NO(g) +
6H2O(g),下列叙述正确的是 ( )
4NO(g) +
6H2O(g),下列叙述正确的是 ( )
A、达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
B、若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C、达到化学平衡时,NH3的含量保持不变
D、化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
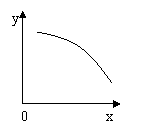 4、在一定条件下,固定容积的密闭容器中的反应2NO2(g)
4、在一定条件下,固定容积的密闭容器中的反应2NO2(g)![]() O2(g)+ 2NO(g)(正反应为吸热反应)达到平衡。当改变其中一个条件X,则Y随X的变化符合图中曲线的是 ( )
O2(g)+ 2NO(g)(正反应为吸热反应)达到平衡。当改变其中一个条件X,则Y随X的变化符合图中曲线的是 ( )
A、当X表示NO2的物质的量时,则Y表示O2的物质的量
B、当X表示压强时,Y表示混合气体的平均相对分子质量
C、当X表示反应时间时,Y表示混合气体的密度
D、当X表示温度时,Y表示NO2的物质的量
5、下列化学名词正确的是( )
A、三溴笨酚 B、有机玻璃 C、胺基酸 D、石碳酸
6、下列说法正确的是( )
A、有机物一定含有氢元素 B、有机物一定可以燃烧
C、有机物燃烧后只生成二氧化碳和水 D、糖类只含C、H、O三种元素
7、据2005年7月15日中央电视台“新闻30分”报道,由于国内一些媒体大肆炒作我国生产的啤酒中甲醛含量超标,韩国、日本等国家已经开始对从我国进口的啤酒进行检测。下列有关甲醛的叙述不正确的是 ( )
A.甲醛的水溶液能使蛋白质变性,故有杀菌、防腐性能
B.甲醛在常温下是一种无色、有刺激性气味的液体
C.甲醛能与H2发生加成反应,生成甲醇 D.甲醛与乙醛互为同系物
8、油脂水解后的一种共同产物是 ( )
A.硬脂酸 B.甘油 C.软脂酸 D.油酸
9、据央视报道,自2005年12月1日起在武汉九市进行车用乙醇汽油封闭推广行动。车用乙醇汽油是把乙醇和汽油按一定比例配成的一种新型汽车燃料。经多项检测结果表明,它不影响汽车的行驶性能,还可以减少有害气体的排放量。下列有关乙醇汽油的说法正确的是 ( )
A、乙醇和汽油既可作溶剂也可相互溶解 B、乙醇汽油是一种纯净物
C、乙醇汽油作燃料不会产生任何有害气体,其优点是可以减少对环境的污染
D、等物质的量的乙醇和乙二醇与足量钠反应产生氢气的体积比为2 :1
10、青苹果汁遇碘溶液显蓝色,熟苹果能还原银氨溶液,下列说法正确的是 ( )
A.青苹果中只含淀粉不含糖类 B.淀粉与纤维素互为同分异构体
C.熟苹果中含还原性糖 D.苹果转熟时单糖发生了水解
11、化学式为C6H14的各种同分异构体中,含有3个“—CH3”的同分异构体的数目为( )
A.2种 B.3种 C.4种 D.5种
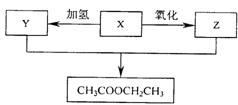 12、某有机化合物X,经过下列变化后可在一定条件下得到乙酸乙酯。则有机物X是( )
12、某有机化合物X,经过下列变化后可在一定条件下得到乙酸乙酯。则有机物X是( )
A 、C2H5OH B 、 C2H4
C 、 CH3CHO D 、 CH3COOH
13、一种气态烷烃和一种气态烯烃组成的混合物共5g,该混合物的密度是相同条件下H2密度的12.5倍。若将混合气体缓慢通过盛有足量溴水的试剂瓶,试剂瓶增重4.2g,该混合气体可能是( )
A、乙烷和乙烯 B、乙烷和丙烯 C、甲烷和乙烯 D、甲烷和丙烯
14、下列物质中,在一定条件下既能和硝酸又能和NaOH溶液反应的物质( )
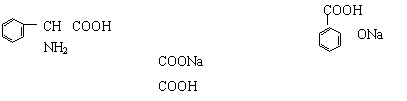 |
 ①
②HOCH2CH2COOH ③
①
②HOCH2CH2COOH ③
④CH3COONH4 ⑤
A、有 2种 B、有3种 C、有4种 D、有5种
15、有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占的体积相同,则甲的可能结构有( )
A、8种 B、14种 C、16种 D、18种
吉安市高二下学期期末检测2006.6
| |||||
| 大题 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
第I卷选择题答题栏(3分×15=45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
第II卷(非选择题,共55分)
二、本题包括2小题,共18分。
| 得分 |
16、(7分)请按要求填空:
(1)下列实验操作或对实验事实的叙述正确的是 (填序号)
①配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
②用碱式滴定管量取20.00 mL 0.1000 mol/L KMnO4溶液;
③用托盘天平称取10.50 g干燥的NaCl固体;
④配制Al2(SO4)3溶液时,加入少量的稀硫酸。
⑤用植物油从溴水中萃取Br2
⑥用Fe(SCN)3溶液来检验Fe3+
(2)下列实验:①实验室制乙烯 ②实验室制乙炔 ③银镜反应 ④酯的水解 ⑤石油的分馏 ⑥制乙酸乙酯 ⑦用新制Cu(OH)2检验醛基,需要使用温度计的是_______________(填编号)。
(3)做过苯酚性质实验的试管可用 洗涤;配制银氨溶液应选用
(填“浓氨水”或“稀氨水”);做过银镜反应的的试管应用 (填“浓HNO3”或“稀HNO3”)洗涤更好。
| 得分 |
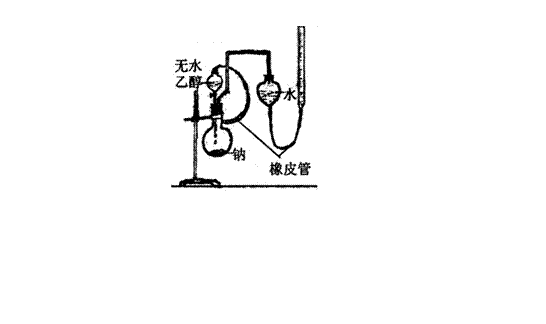
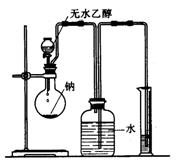 17、(11分)教材中测定乙醇跟钠反应放出氢气体积的装置如右图,请回答下列相关问题:
17、(11分)教材中测定乙醇跟钠反应放出氢气体积的装置如右图,请回答下列相关问题:
(1) 该套装置组装好后,在加入药品前必须进行的操作为
(2)为通过实验确定乙醇的结构式,应使用
(填“过”或“一定”)量的钠与 (填“过”或“一定”)量的无水乙醇进行反应。
(3)上述物质要适当过量的原因是:① ,
 ②
②
(4)若将教材中的实验装置改成如右图装置(玻璃器皿间用
橡皮管联结),则该装置与原装置相比较主要的优点有:
a
b
c
d (可以不填满,也可以再补充)
三、本题包括4小题,共28分
| 得分 |
18(5分)下图是由4个碳原子结合成的6种有机物的球棍模型(H原子没画出)
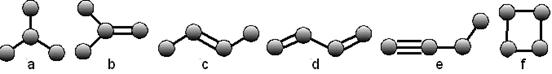
(1)有机物a的名称 (用系统命名法)。
(2)上述有机物中与c互为同分异构体的是 (填代号)。
(3)在a、b、c、d、e五种物质中,4个碳原子一定处于同一平面的有 (填代号)。
(4)写出b发生加聚反应的化学方程式:
| 得分 |
19、(4分)某同学设计一原电池,装置图如右。请按要
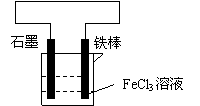 求回答下列问题:
求回答下列问题:
(1)石墨为 极,铁棒为 极 。
(2)正极的电极反应式:
负极的电极反应式:
| 得分 |
20、( 7分)物质A~G有如下转化关系,反应条件已省去
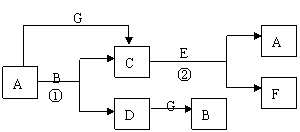 | |||
| | |||
已知:①A、D、E、G为单质
②F为两性氧化物
③C是具有磁性的黑色晶体
请回答下列相关问题:
(1) B的电子式为
(2) 完成相关的化学方程式
反应①:
反应②:
(3) 写出“E”和NaOH溶液反应的离子方程式
| 得分 |
21( 12分)A~H有如下转化关系,有些反应条件已省去,已知
①A与HCl反应的产物中既有B又有C; ②E可以发生银镜反应.
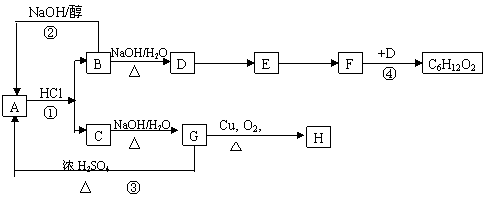 |
请回答下列相关问题:
(1)写出C的结构简式
(2)写出有关物质的官能团的结构简式A D
(3)A~H中互为同分异构体有 (填字母)
(4)反应类型:①为 反应,③为 反应
(5)上述转化关系中,取代反应共有 个。
(6)完成反应④的化学方程式
四、本题包括1小题,共9分
| 得分 |
22、(9分)烷烃R与炔烃Q常温下为气体,有A、B两份混合气体,A是R和足量O2的混合气体,B是R、Q和足量O2的混合气体。各取2.24 L A、B引燃,A充分燃烧后的气体总体积仍为2.24 L,B充分燃烧后气体总体积为2.38 L(体积均在相同条件下测定且温度均超过100℃),请回答:
(1)烷烃R的分子式为 ,炔烃Q的分子式为 。
(2)2.24 L混合气体 B中,烷烃R所允许的最大体积为 L。
吉安市高二下学期期末检测2006.6
化学参考答案及评分标准
一、选择题(3分×15=45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | C | A | C | D | B | D | B | B | A | C | A | C | C | D | C |
16. (7分)(1)①④(2分) ( 选对1个给1分,错选1个扣1分但不出现负分)
(2)①⑤ (2分) ( 选对1个给1分,错选1个扣1分但不出现负分)
(3)酒精或氢氧化钠溶液(写开水、热水也给分);稀氨水;稀HNO3(每空1分共3分)
17、(11分)(1)检验装置的气密性 ( 2分 ) (2)过 ( 1分),一定( 1分)
(3)①保证乙醇完全反应( 2分 ) 。②钠在取用及加入过程中表面部分会被氧化(2分)
(4)a乙醇容易滴入烧瓶中 b定量的乙醇可以全部加入烧瓶,而不用担心氢气逸出。
c氢气的体积测量更准确,原装置中导管内的水柱的体积难以测量准确 。
d 可以克服乙醇滴入时排出气体而使体积H2测量结果偏大这一缺点 (答对1点给1分,答对2点给3分,答对3点或4点均给3分,答错的不倒扣分,共3分)
18、(5分)
(1) 2-甲基丙烷 (1分)
(2)
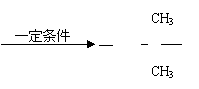 b、f (1分,少填或错填均给0分)
b、f (1分,少填或错填均给0分)
(3)
![]() b、c、e
(1分少填或错填均给0分)
b、c、e
(1分少填或错填均给0分)
(4)
![]() n (CH3)2C=CH2
[ CH2 C
]n
(2分)
n (CH3)2C=CH2
[ CH2 C
]n
(2分)
19、(4分)(每空1分)(1)正(或+), 负或(一)。
![]() (2)Fe3++e- == Fe2+ ( 写成2 Fe3++2e- == 2Fe2+ 也给满分 ) Fe -2e- == Fe2+
(2)Fe3++e- == Fe2+ ( 写成2 Fe3++2e- == 2Fe2+ 也给满分 ) Fe -2e- == Fe2+
 20、(7分)(1)H:O:H
(1分)
20、(7分)(1)H:O:H
(1分)
(2) 3Fe + 4 H2O ========= Fe3O4 + 4H2 (2分)
8 Al +3Fe3O4======== 4Al2O3 + 9Fe (2分)
(3)2Al + 2OH- +2H2O ==== 2AlO2- +3H2↑ (2分)
![]() 21、(12分)(1)CH3CHCH3 2分2)
C=C (写C=C也可给分) ,—OH 各1分
21、(12分)(1)CH3CHCH3 2分2)
C=C (写C=C也可给分) ,—OH 各1分
Cl
(3)B与C,D与G,E与H 3分(4)加成,消去 每空1分
(5)3 1分
(6)CH3CH2COOH+CH3CH2CH2OH ![]() CH3CH2COOCH2CH2CH3+H2O 2分
CH3CH2COOCH2CH2CH3+H2O 2分
22、(9分)(1)CH4;C4H6 (2)0.14 每空3分