孙疃第中学《化学平衡》单元测验题试卷
2005/9
班级 姓名 学号
一、选择题(每小题只有一个正确答案,每小题4分)
1.仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是 ( )
A.加热 B.加压 C.加负催化剂 D.加大反应物浓度
2. 可逆反应达到平衡的最主要特征是
( )
A.正逆反应速率相等
B.正逆反应速率均为零
C.正逆反应都还在继续进行
D.反应停止了
3. 在一定条件下,可逆反应 2SO2+ O2![]() 2SO3达到平衡后,充入18O2,则18O将存在于
2SO3达到平衡后,充入18O2,则18O将存在于
A. O2 B. O2、SO3 C. SO2、SO3 D. SO2、O2、SO3
4.下列变化不能用勒夏特列原理解释的是 ( )
A.红棕色的NO2加压后颜色先变深再变浅 B.H2、I2、HI混合气体加压后颜色变深
C.合成氨时采用循环操作,可提高原料的利用率 D.打开汽水瓶,看到有大量的气泡逸出
5.可逆反应:N2+3H2
![]() 2NH3的正、逆反应速度可用各反应物或生成物浓度变化来表示。下列各关系中能说明反应已经达到化学平衡的是 ( )
2NH3的正、逆反应速度可用各反应物或生成物浓度变化来表示。下列各关系中能说明反应已经达到化学平衡的是 ( )
A.3v正(N2)=v逆(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v正(NH3) D.v正(N2)=3v逆(H2)
6.在N2+3H2![]() 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol•L-1,此时间内用H2表示的平均速率为0.45mol•(L•s)-1,则这段时间值是
( )
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol•L-1,此时间内用H2表示的平均速率为0.45mol•(L•s)-1,则这段时间值是
( )
A.1s
B.0.44s
C.2s
D.1.33s
 7. 有一处于平衡状态的反应:X(g)+3Y(g)
7. 有一处于平衡状态的反应:X(g)+3Y(g) ![]() 2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是
( )
2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是
( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥除去Z
A.①④⑥ B.②③⑤ C.①③⑥
D.②③⑥
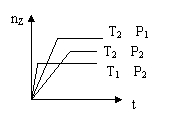
8. 反应2X(g)+Y(g)![]() 2Z(g)+热量,在不同温度(T1和T2)及压强(P1和 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
( )
2Z(g)+热量,在不同温度(T1和T2)及压强(P1和 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
( )
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
9.下列各电离方程式中,书写正确的是 ( )
![]()
![]() A.CH3COOH H++CH3COO- B
KHSO4
H++SO42-+K+
A.CH3COOH H++CH3COO- B
KHSO4
H++SO42-+K+
![]()
![]() C H2CO3
2H++CO32- D
NaH2PO4 Na++H2PO4-
C H2CO3
2H++CO32- D
NaH2PO4 Na++H2PO4-
10.足量的镁粉与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但不影响氢气产生的总量,可以加入下列物质中的 ( )
A MgO B NaOH C K2CO3 D CH3COONa
二、选择题(每小题只有一个或两个正确答案,每小题4分)
11. 某温度下:H2(g)+I2(g) ![]() 2HI(g)在密闭容器中达到平衡,缩小容积,增大压强 ( )
2HI(g)在密闭容器中达到平衡,缩小容积,增大压强 ( )
A.正反应速率增大
B.平衡正向移动
C.容器内气体颜色加深
D.容器内H2的质量分数增大
12.硫燃烧的主要产物是SO2,但也有少量的SO3生成。对于后一过程,温度的影响大于浓度的影响。取一定量的硫在密闭且容积相同分别盛有空气和纯氧的容器中燃烧,产生SO3的体积分数分别为a 和b,则a 和b 关系正确的是
( )
A.a > b B.a < b C.a
= b D.无法确定
13.在一固定容积的容闭容器中,加入2 L X 和3 L Y 气体,发生如下反应:
n X(g) + 3Y(g) ![]() 2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,则化学方程式中的n 值为 ( )
2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,则化学方程式中的n 值为 ( )
A.1 B.2
C.3
D.4
14. 二氧化氮存在下列平衡:2NO2(g) ![]() N2O4(g)+Q
在测定NO2的相对分子质量时,应尽可能的提高NO2的含量,下列条件中较为适宜的是
( )
N2O4(g)+Q
在测定NO2的相对分子质量时,应尽可能的提高NO2的含量,下列条件中较为适宜的是
( )
A. 温度130℃、压强3.03×105Pa B. 温度25℃、压强1.01×105Pa
C. 温度130℃、压强5.05×104Pa D. 温度0℃、压强5.05×104Pa
15. 在一密闭容器中,反应 aA(气)![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
 C.物质B的质量分数增加了
D.a>b
C.物质B的质量分数增加了
D.a>b
16.对于mA(s)+nB(g)![]() pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
A.m+n<p
B.n>p
C.x点的状态是v正>v逆
 D.以上答案都错误
D.以上答案都错误
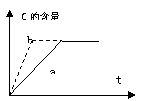
17.对可逆反应:A(g) + B(g) ![]() 2C(g) +D(s) + Q,根据右图,从a反应历程改变为b反应历程,所采取的措施是 ( )
2C(g) +D(s) + Q,根据右图,从a反应历程改变为b反应历程,所采取的措施是 ( )
A.增大B的浓度
B.升高温度
C.加入催化剂
D.减小压强
18.已知723K时有反应:2SO2(g)+O2(g) ![]() 2SO3(g)+Q。在相同温度条件下,向一密闭容器中通入2molSO2和1 molO2达平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入1molSO2和0.5molO2达平衡时,放出的热量为Q2,则Q1、Q2满足的关系是 ( )
2SO3(g)+Q。在相同温度条件下,向一密闭容器中通入2molSO2和1 molO2达平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入1molSO2和0.5molO2达平衡时,放出的热量为Q2,则Q1、Q2满足的关系是 ( )
A.Q2=Q1/2 B.Q2<Q1/2 C.Q2<Q1=Q D.Q1=Q2<Q
19.某温度下,C和水在密闭容器中发生下列反应: ( )
C(s)+H2O(g) ![]() CO(g)+H2,
CO(g)+H2O(g)
CO(g)+H2,
CO(g)+H2O(g) ![]() CO2(g)+H2
CO2(g)+H2
当反应达平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为
A.0.1mol/L B. 0.9mol/L C. 1.8mol/L D. 1.9mol/L
20.在密闭容器中投入1mol CO(g)和3mol H2O(g), 下列反应:CO(g)+H2O(g) ![]() CO2(g)+H2,达到平衡后,测得CO2(g)为0.75mol, 再向其中加入5mol H2O(g),达到新平衡后,CO2(g)的物质的量可能的是
( )
CO2(g)+H2,达到平衡后,测得CO2(g)为0.75mol, 再向其中加入5mol H2O(g),达到新平衡后,CO2(g)的物质的量可能的是
( )
A.0.50mol B. 0.75mol C. 0.85mol D. 1.1mol
高二化学月考试卷(第二卷)
班级 学号 姓名 成绩
三、填充题
21.工业合成氨时选择500℃的主要原因是 (2分);
工业合成硫酸时在沸腾炉中将黄铁矿煅烧时,先要粉碎黄铁矿,主要原因是
(2分)。
22.现有如下物质:①酒精、②铜、③氢氧化钡、④氨、⑤蔗糖、 ⑥高氯酸、⑦硫酸钾、⑧磷酸、⑨硫化氢、⑩硫酸。请用物质的序号填写下列空白(10分):
属于强电解质的有: 。属于弱电解质的有: 。
属于非电解质的有: 。液态时能导电的有: 。
液态时不导电,其水溶液导电的有: 。
23.已知①氨水溶液中存在平衡:NH3+H2O![]() NH3·H2O
NH3·H2O ![]() NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之(5分)。
NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之(5分)。
。
24.近年来,某些自来水厂在用液氯进行消毒处理时还加入少量的液氨,其反应的化学方程式为:NH3 + HClO![]() H2O + NH2Cl(一氯氨),NH2Cl较HClO稳定,加液氨能延长液氯杀菌时间的原因
H2O + NH2Cl(一氯氨),NH2Cl较HClO稳定,加液氨能延长液氯杀菌时间的原因
是 (3分) 。
25.夏天,鸡没有汗腺只能依赖“喘息”调节体温。鸡过度的呼出CO2,使下列平衡向左移动,导致蛋壳变薄,使农场主和超市经营者蒙受经济损失(2分)。
CO2(g) ![]() CO2(aq),CO2(aq)+H2O
CO2(aq),CO2(aq)+H2O![]() H2CO3(aq);H2CO3(aq)
H2CO3(aq);H2CO3(aq) ![]() H+(aq)+HCO3-
(aq)
H+(aq)+HCO3-
(aq)
HCO3- (aq) ![]() H+(aq)+CO32-
(aq);Ca2+(aq)+CO32-
(aq)
H+(aq)+CO32-
(aq);Ca2+(aq)+CO32-
(aq) ![]() CaCO3(s)(蛋壳)
CaCO3(s)(蛋壳)
澳大利亚学者经研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚。这种饮料是 。
A.淡盐水 B.碳酸水 C.蔗糖水 D.澄清石灰水 E.醋酸水 F.苏打溶液
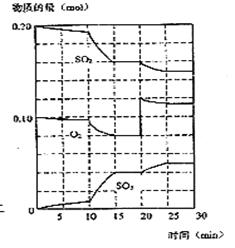 26. 在一定条件下,二氧化硫和氧气发生如下反应(10分):
26. 在一定条件下,二氧化硫和氧气发生如下反应(10分):
2SO2(g)+ O2
(g) ![]() 2SO3(g) +
Q (Q>0)
2SO3(g) +
Q (Q>0)
(1)降低温度,该反应二氧化硫转化率 ,化学反应速度 ,(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(3)据图判断,反应进行至20min时,曲线发生变化的原因
(用文字表达)
10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
 27. 2A
27. 2A ![]() B+C在某一温度时,达到平衡(10分)。
B+C在某一温度时,达到平衡(10分)。
(1) 若温度升高,平衡向正反应方向移动,则正反应是______热反应;
(2) 若B为固体,降低压强平衡向逆反应方向移动,则A呈_______态;
(3) 若A是气态时,加压时,平衡不移动,则B为______态,C为_____态。
28.有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比为2∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO2+O2![]() 2SO3,并达到平衡。
2SO3,并达到平衡。
⑴ 达到平衡所需时间,A容器比B容器_______,两容器中SO2的转化率A比B______。
⑵ 达到⑴所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡________移动。
⑶ 达到⑴所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数________,B容器中SO3的体积分数__________(填变大、变小、不变)。
四、实验题(5+4分)
29.现有两瓶失去标签的试剂分别是0.1mol/L、1.0mol/L的硫酸溶液,请用实验方法加以确认。可用的试剂是:1.0mol/L的Na2S2O3溶液、1.0mol/L的BaCl2溶液、锌粒,水。化学仪器任选。
30.比较下列实验现象,回答问题进行填空:有A、B两试管,分别装有等量碳酸氢钠固体,然后往A、B两试管中分别倒入足量的相同物质的量浓度,相同体积的稀盐酸和稀醋酸,回答:
(1)A、B两试管中的反应现象:
相同点是: 。 不同点是: 。
原因是: 。
(2)A、B两试管中生成气体的体积: (填相等或不相等)
五、计算题
31.将2molN2和8mol H2在适宜条件下按下式进行反应:N2+3H2![]() 2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?(7分)
2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?(7分)
32.已知t℃、101kPa时容积可变的密闭容器中充入2molA和1molB,此时容器的体积为V
L,发生反应2A(g)+B(g)
![]() 2C(g),达平衡时,C的体积分数是0.4。(10分)
2C(g),达平衡时,C的体积分数是0.4。(10分)
(1)若恒温恒压时,开始充入4molC,达平衡时C的体积分数是 ,容器的体积为 L。
(2)若另选一容积不变的密闭容器,仍控制温度为t℃,开始充入4molA和2molB,反应达平衡时C的体积分数是0.4,压强为101kPa。则该容器的体积为 L。
(3)若控制温度为t℃,另选一容积不变的密闭容器,其体积为VL, 开始充入一定量的A和B,达到平衡时C的体积分数仍是0.4,则开始充入的A和B物质的量应满足 a<nA/nB<b,其中a为 ,b为 。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | A | D | B | A | C | D | C | A | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A、C | A | A | C | AC | C | C | B | B | C |
21、催化剂活性最强。增大固体表面积,硫铁矿煅烧速率快。
22、3、6、7、10;8、9 ;1、4、5;2、3、7;4、6、8、9、10;
23、CaO+H2O=Ca(OH)2 放热、耗水、COH-增大,都导致氨水中的平衡逆移,有利于氨气逸出。
24、(1)生成稳定的NH2C1,导致自来水中HC1O浓度下降,HC1O分解速率降低。
(2)反应后+1价氯元素的总量未减少,当HC1O被消耗时,平衡逆移,维持较大HC1O浓度
25、B、F
26、增大;减小;15 min~20min及25 min~30 min;增大了O2的浓度;a、b
27、吸,气;气;气;
28、短;大;逆反应方向;不;不变;变大。
29、略
30、都又气体放出;盐酸的快,醋酸的慢;盐酸、醋酸的酸性都大于碳酸,且盐酸是强电解质,溶液中H+浓度大于同浓度弱电解质的醋酸;相同。
31、35.2%
32、0.4;5v/3;5v/3;1/2;5