桐庐中学2005学年第一学期高二年级第二次教学质量检测
化学试题卷(理科)
命题人:吴荣清 审核人:施小萍
本试题采用相对原子质量:O:16、Cu:64、S:32、H:1、Fe:56、Ba:137
一、选择题(本题包括25小题,每小题只有一个正确答案,每小题2分,共50分)
1.下列物质使用不合理的是
A、用白磷制安全火柴 B、液氨作致冷剂
C、明矾用作工业用水的净水剂 D、金的合金用于制造笔尖材料
2.检验市面上的金器首饰是否用纯金制成,可取样品与一种试剂进行反应,根据现象即可判断,所取的试剂是
A、 盐酸 B、 硝酸 C、王水 D、硫酸
3.不能由单质直接化合而得到的化合物是
A、FeCl2 B、Al2S3 C、FeS D、Fe3O4
4.在一个恒容的密闭容器中进行的如下反应2SO2
+O2![]() 2SO3,已知反应过程中,某一时刻SO2、SO3、、O2的浓度分别是0.2mol/L、0.2mol/L、0.1mol/L
,当反应达到平衡时可能存在的数据是
2SO3,已知反应过程中,某一时刻SO2、SO3、、O2的浓度分别是0.2mol/L、0.2mol/L、0.1mol/L
,当反应达到平衡时可能存在的数据是
A.c(SO2)=0.4mol/L B.c(SO2)=0.25 mol/L
C.c(SO2)= c(SO3)=0.15mol/L D.c(SO3)=0.4mol/L
5.下列叙述中,不能证明某物质是弱电解质的是
A、测定0.1mol·L-1 的一元酸溶液,测得其PH值为2
B、不是离子化合物,而是极性共价化合物
C、稀释某一元酸HR溶液1000倍,PH值从3变为5
D、测定0.10mol·L-1盐NaR溶液PH=8,说明酸HR为弱电解质
6.在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A、中和时所需NaOH的量 B、氢离子浓度
C、氢离子的物质的量 D、CH3COOH的物质的量
7.为了迅速除去镀在铝表面上的铜镀层,可选用的试剂是
A、稀硝酸 B、浓硝酸 C、浓硫酸 D、浓盐酸
8.下列说法正确的是
A、pH=2和pH=1的硝酸中c(H+)之比为1:10
B、Na2CO3溶液c(Na+)与c(CO![]() )之比为2:1
)之比为2:1
C、0.2 mol·L-1与0.1 mol·L-1醋酸中c(H+)之比为2:1
D、NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1
9.相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A、NH4Cl B、NH4HCO3 C、NH4HSO4 D、(NH4)2SO4
10.用物质的量都是0.1mol的CH3COOH和CH3COONa在常温下配成1L混合溶液,已知其中的c(CH3COO-)>c(Na+),则对该混合溶液的下列判断中正确的是:
①c(H+)>c(OH-) ②c(CH3COO-)+ c(CH3COOH)=0.2mol/L
③c(CH3COO-)< c(CH3COOH) ④c(CH3COOH) +c(OH-)=0.1mol/L
A、只有② B、 ①和② C、 ①②③ D、全部正确
11.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A、V1>V2 B、V1<V2 C、V1=V2 D、V1≤ V2
12.下列关系一定正确的是
A、当溶液中c(H+)>10-7 mol«L-1时,其pH<7,溶液呈现酸性
B、当溶液中c(H+)>10-7 mol«L-1时,其pH>7,溶液呈现碱性
C、当溶液中c(H+)=c(OH-)>10-7 mol«L-1时,其pH<7,溶液呈现中性
D、当溶液中c(H+)=c(OH-)>10-7 mol«L-1时,其pH<7,溶液呈现酸性
13.已知一种c(H+)=1×10-3 mol·L-1 某酸溶液跟一种c(OH-)=1×10-3 mol·L-1 某碱溶液等体积混合后溶液呈酸性。其原因可能是
A、稀的强碱与浓的强酸反应
B、等物质的量浓度的一元强酸和一元弱碱反应
C、浓的弱酸与稀的强碱溶液反应
D、生成一种强酸弱碱盐
14.实验室用固体氯化铁配制氯化铁溶液时,通常用的方法是
A、氯化铁固体溶于适量的蒸馏水中搅拌即成
B、将氯化铁固体溶于水后再滴加几滴稀盐酸
C、氯化铁固体溶于水后,再滴加几滴稀盐酸并在溶液中放人一枚铁钉
D、氯化铁固体溶解在浓盐酸中,然后再用水稀释到所需浓度
15.常温下,向氨水中滴加盐酸至溶液的pH=7为止,溶液中离子浓度大小关系的排列正确的是
A. c(H+)=c(OH-)<c (NH4+) <c(Cl-)
B. c (Cl-)> c (NH4+)>c (H+)>c (OH-)
C. c (NH4+)>c (Cl-)>c (H+)=c (OH-)
D. c (NH4+)+c (H+)=c (Cl-)+c (OH-)
16.已知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是
A、Al3+、CH3COO—、Cl—、AlO![]() B、Mg2+、Ba2+、Br— 、HCO3-
B、Mg2+、Ba2+、Br— 、HCO3-
C、Mg2+、Cl—、I— 、Fe2+ D、Na+、NH4+、Cl—、Fe3+
17.下列四个实验中,花的颜色发生变化但仍较鲜艳的实验是
A、将一支花置于充满二氧化硫气体的瓶中数日
B、将一支花置于充满氯气的瓶中数日
C、将一支花插入碳酸钠稀溶液中数日(每日更换碳酸钠稀溶液)
D、将一支花插入氯化钠稀溶液中数日(每日更换氯化钠稀溶液)
18.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A、稀硝酸 B、稀盐酸 C、硝酸铜 D、氢氧化钠
19.在常温下,将等物质的量的镁和铝相混合,取四份等质量的该混合物分别加入到足量的下列溶液,充分反应后,放出氢气最多的是
A、3mol/L HCl B、4mol/L HNO3 C、8mo1/L NaOH D、18mol/LH2SO4
20.把Ba(OH)2溶液滴入明矾溶液中,使SO![]() 全部转化成BaSO4沉淀,此时铝元素的主要存在形式是
全部转化成BaSO4沉淀,此时铝元素的主要存在形式是
A、Al3+ B、Al(OH)3 C、AlO![]() D、Al3+和Al(OH)3
D、Al3+和Al(OH)3
21.下列离子方程式中,正确的是
A、向氯化亚铁溶液中通入氯气;Fe2++Cl2 Fe3++2Cl-
B、三氯化铁溶液跟过量氨水反应; Fe3++3 OH- Fe(OH)3↓
C、铝条放入氢氧化钠溶液中;2Al+2OH-+2H2O=2AlO2-+3H2↑
D、Na2CO3溶液显碱性;CO32—+H2O=HCO3-+OH-
22.将铁粉、铜粉、氧化铁粉末的混和物与适量盐酸反应,反应后铁和铜的单质剩余时,溶液中含有的金属阳离子是
A、Fe3+ B、Fe2+ C、Fe2+和Cu2+ D、Cu2+
23.向含下列离子的溶液中,加足量氢氧化钠溶液,静置、过滤,取沉淀洗涤后加足量盐酸,得到的溶液所含金属阳离子与原溶液相同的是
A、Na+、Mg2+ B、Fe2+、Cu2+
C、Al3+、Cu2+ D、Mg2+、Fe3+
24.点燃的镁带在SO2中能够象在CO2中那样继续燃烧,但反应较镁和CO2剧烈。反应结束后,在原盛有SO2的集气瓶内壁可能附着的固体有
①MgO ②S ③MgS
A、只有①③ B、只有①② C、只有②③ D、①②③
25、在一些高档食品的包装盒中常常放置一个小袋,小袋内装有灰黑色粉末,一段时问后,有部分粉末会变成棕褐色。若将灰黑色粉末溶于盐酸后取上层清液,滴入几滴氯水,再滴一KSCN溶液,马上出现血红色。以下结论不正确的是
A、小袋中原来装有铁粉 B、小袋中原来装有Fe203
C、该灰黑色粉末用作抗氧化剂 D、该灰黑色粉末不可食用
二、简答题(本题包括3小题,共21分)
26.(7分)根据题意完成下列各小题:
(1)除去FeCl2溶液中的少量FeCl3杂质,其离子方程式为 ▲ 。
(2)用离子方程式或电离方程式表示NaHCO3溶液中存在的三个平衡: ▲ ;
▲ ; ▲ 。
(3)以四氧化三铁为原料,铝热法制取铁 ▲ 。
(4)写出将AlCl3溶液逐滴加入NaOH溶液中的有关离子方程式 ▲ 。
27.(6分)有a、b两个极易导热的密闭容器,a保持体积不变,b中的活塞可上下移动以保持内外压强相等。在相同体积下将3molA和1molB分别同时混合于a、b两容器中发生如下反应:3A(g)+B(g) ![]() 2C(g)+D(g)
2C(g)+D(g)
(1)达到平衡时a中A的浓度为M mol/L,C的浓度为N mol /L, b中A的浓度为m mol/L,C的浓度为n mol/L, 则M ▲ m;N ▲ n (填">"、"<"、"=")
(2)保持温度不变,按下列配比分别充入a、b两容器,平衡后a中的C的浓度仍为N mol/L的是 ▲ ;b中C的浓度仍为n mol/L的是 ▲ 。
A、6molA+2molB B、3molA+2molB
C、2molC+1molB+1molD D、1.5molA+0.5molB+1molC+0.5molD
(3)若将2molC和2molD充入 a中,保持温度不变,平衡时A的浓度为W mol/L, C的为Y mol/L,则W ▲ M,Y ▲ N (填">"、"<"、"=")。
28.(8分)A、B、C、D、E、F六种物质的相互转化关系如下图所示。已知A、B、X均为常见非金属单质。
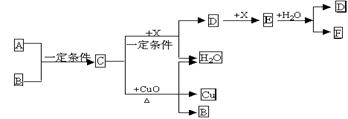 |
(1)A的分子式为_____▲________;C的电子式为____▲_______________
(2)写出下列反应的化学方程式:C + CuO →:_______ ▲_______________
(3)实验室常用Cu和F的溶液来制备E,你认为F的溶液使用浓的好,还是稀的好。____▲____(填“浓”或“稀”)理由是_____▲_______
三、实验题(本大题共3小题,共18分)
29.(3分)用正确方法除去括号中的少量杂质,请将所选用的试剂填写在横线上。
(1)FeCl3(FeCl2) ▲ 。
(2)Mg(OH)2(Al(OH)3) ▲ 。
(3)Na2CO3(Na AlO2) ▲ 。
30.(6分)请用下列所给出的试剂,用三种简便的方法证明一元酸HR是弱酸,简要写出该实验的步骤和应观察到的现象及作出的结论(实验所需的仪器可另选)
限用下列药品:0.1 mol«L-1HCl ,0.1 mol«L-1HR溶液,蒸馏水,pH试纸,锌粒
方法一: ▲
方法二: ▲
方法三: ▲
31.(9分) 某学生有0.10mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(B)用标准溶液润洗滴定管2~3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
(E)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度
(F)调节液面至0或0刻度以下,记下读数
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)___▲_____。
(2)上述(B)操作的目的是_____▲______。
(3)实验中用左手控制____▲____(填仪器及部位),眼睛注视____▲_____,直至滴定终点。判断到达终点的现象是____▲_____。
(4)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察碱式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 ▲ 。
②若将锥形瓶用待测液润洗,然后再加入20.00mL待测液,则滴定结果 ▲ 。
③酸式滴定管未用未知浓度的盐酸溶液润洗就直接注入未知浓度的盐酸溶液 ▲ 。
④若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是____▲____。
四、计算题(本大题共2小题,共11分)
32.(5分)有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。
(1)如果加入蒸馏水,就加入____▲____ mL
(2)如果加入pH = 10的NaOH溶液,应加入__▲____ mL
(3)如果加入0.008 mol/L HCl溶液,应加入___▲_____ mL
33.(6分)在500mLCuSO4和Fe2(SO4)3的混合溶液中加入16.8g铁粉,搅拌并充分反应后,经过滤、洗涤、干燥,可得6.4g铜。要使滤液中SO42-完全沉淀,需加入2.0mol/LBaCl2溶液500mL。已知Fe3+的氧化性比Cu2+强,求:(1)原混合溶液中SO42-的物质的量浓度。(2)原混合溶液中CuSO4和Fe2(SO4)3的物质的量浓度。