高二化学(上学期)期中试卷及试卷分析
相对原子质量:H:1 N:14 O:16 Na:23 Mg:24 Al:27
一. 选择题(每小题只有一个选项符合题意)
1. 在N2+3H2![]() 2NH3的反应中,经一段时间后,NH3的物质的量浓度增加了0.6mol/ L,在此时间内用H2物质的量浓度表示的平均速率为0.45mol/(L·s),则反应所经过的时间为( )
2NH3的反应中,经一段时间后,NH3的物质的量浓度增加了0.6mol/ L,在此时间内用H2物质的量浓度表示的平均速率为0.45mol/(L·s),则反应所经过的时间为( )
A. 0.2s B. 1.0s C. 1.5s D. 2.0s
2. 把镁带投入盛有稀HCl的容器里,产生H2的速率与下列因素:① 盐酸浓度,② 温
度,③ 镁带的表面积,④溶液的氯离子浓度,有关系的是( )
A. ①② B. ③ C. ①②③ D. ①②③④
3. 对已达化学平衡的下列反应![]()
![]()
![]() 减小压强时,对反应产生
减小压强时,对反应产生
的影响是( )
A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C. 正、逆反应速率都减小,平衡向逆反应方向移动
D. 正、逆反应速率都增大,平衡向正反应方向移动
4. 下列操作不能用于检验![]() 的是( )
的是( )
A. 气体使湿润的酚酞试纸变红
B. 气体能使湿润的红色石蕊试纸变蓝
C. 气体与浓![]() 生成铵盐
生成铵盐
D. 气体与浓盐酸产生铵盐
5. 在稀硝酸中,能大量共存的离子组是( )
A. Ag+ Cl- B. NH4+ Cl- C. I- Na+ D. CO32- K+
二. 选择题(每小题有1—2个选项符合题意)
6. 一定温度下,可逆反应![]()
![]()
![]() 在体积固定的密闭容器
在体积固定的密闭容器
中反应,达到平衡状态的标志是( )
① 单位时间内生成n molO2,同时生成2n molNO2
② 单位时间内生成n molO2,同时生成2n molNO
③ 用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1
④ 混合气体的压强不再改变
⑤ 混合气体的颜色不再改变
⑥ 混合气体的平均相对分子质量不再改变
A. ①④⑤⑥ B. ①②③⑤ C. ②③④⑥ D. 以上全部
7. 在一定条件下,反应CO+NO2 ![]() CO2+NO 达到平衡后,降低温度,混合气体的颜色变浅。下列判断正确的是( )
CO2+NO 达到平衡后,降低温度,混合气体的颜色变浅。下列判断正确的是( )
A. 正反应为吸热反应 B. 正反应为放热反应
C. CO的浓度增大 D. 物质的浓度不变
8. 某温度下在密闭容器中进行SO2的催化氧化,若起始时![]() = 6mol/ L,平衡时测得
= 6mol/ L,平衡时测得![]() = 4.5mol / L,则下列叙述中正确的是( )
= 4.5mol / L,则下列叙述中正确的是( )
A. SO2的转化率为60%
B. SO3的产率为50%
C. 平衡时总压强与起始压强之比为7:8
D. 平衡时![]() =3:3:1
=3:3:1
9. 在一个固定容积的密闭容器中发生如下反应( )
2A(气)+B(气)![]() 3C(气)+D(气)
3C(气)+D(气)
当加入4molA和2molB,达化学平衡时,C的物质的量浓度为mmol/L。若维持温度不变,
按下列四种配比为起始物质,达到化学平衡后,C仍为m mol/L的是( )
A. 2molA+1molB B. 6molC+2molD
C. 3molC+1molD D. 4molA+2molB+3molC
10. 一定条件下可逆反应:![]()
![]()
![]() 在下列四种状态时属于平衡状态的是( )
在下列四种状态时属于平衡状态的是( )
正反应速率 逆反应速率
A. ![]()
![]()
B. ![]()
![]()
C. ![]()
![]()
D. ![]()
![]()
11. 反应
X(气)+ Y(气)![]() 2Z(气) 正反应为放热反应,在一定条件下,反应
2Z(气) 正反应为放热反应,在一定条件下,反应
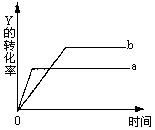
物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是( )
A. 加催化剂 B. 降低温度
C. 增大压强 D. 增大Y的浓度
12. 密闭容器中进行如下反应:X2(气) + Y2(气)![]() 2Z(气),已知 X2、Y2、Z的起始浓度分别为0.1 mol/ L,0.3 mol/L,0.2 mol/ L,在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是( )
2Z(气),已知 X2、Y2、Z的起始浓度分别为0.1 mol/ L,0.3 mol/L,0.2 mol/ L,在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是( )
A. Z 为 0.3 mol/L B. Y2 为 0.35 mol/L
C. X2 为 0.2 mol/L D. Z 为 0.4 mol/L
13. 向饱和食盐水中加入a g Na37Cl,充分搅拌一段时间后,下列叙述正确的是( )
A. 溶质的质量分数不变 B. 溶解度不变
C. 溶液的质量增加 D. 氯化钠固体的质量不变
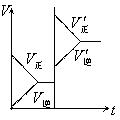
14. 对于已知平衡时的可逆反应x + y ![]() z + w增大压强正逆反应速度的图象如下,
z + w增大压强正逆反应速度的图象如下,
分析图示可知关于x、y、z、w物质的聚集状态是下列的( )
A. z、w均为气体,x、y只有一种是气体
B. z、w中有一种是气体,x、y皆非气体
C. x、y、z皆为气体,w非气体
D. x、y均为气体,z、w中有一种是气体
15. 对于反应:![]()
![]()
![]() 的平衡体系(正反应为放热反应),在其它条件不变时,采取下列措施,其中既能使正、逆反应速率增大,又能使反应物转化率增大的是( )
的平衡体系(正反应为放热反应),在其它条件不变时,采取下列措施,其中既能使正、逆反应速率增大,又能使反应物转化率增大的是( )
A. 增大体系压强 B. 升温 C. 加入铁触媒 D. 减小NH3的浓度
16. ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
A. 1:1 B. 2:1 C. 1:2 D. 2:3
17. 学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶的颜色由白色转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是( )
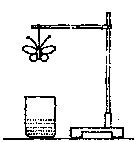
|
| A | B | C | D |
| 纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
| 小烧坏中的溶液 | 浓盐酸 | 浓氨水 | 氢氧化钠溶液 | 浓硫酸 |
18. 下列制取物质的方法合适的是( )
A. 硝酸和FeS反应制H2S
B. 硝酸和![]() 反应制
反应制![]()
C. 硝酸和Na2SO4反应制H2SO4 D. 稀硝酸和Cu反应制NO2
19. 将充满20mLNO的试管,倒置于水中,然后向试管中通入纯净的O2,当试管内液面稳定在试管容积一半时,通入O2的量为( )
A. 35mL B. 25mL C. 17.5mL D. 7.5mL
20. 在烧瓶中充满干燥的标况下HCl与N2的混合气体,已知其相对分子质量是34.8,进行喷泉实验最后所得溶液的物质的量浓度是( )
A. 0.036mol /L B. 0.045mol /L C. 0.8mol /L D. 0.1mol /L
三. 填空题
21. 配平
(1) H2S+ HNO3 S↓+ NO↑+ H2O
(2) Fe3++ H2S Fe2++ S↓+ H+
(3) P+ CuSO4+ H2O Cu+ H3PO4+ H2SO4
22. CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如
下平衡:
[![]() ]2++4C1-
]2++4C1-![]() [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
(蓝色) (黄色)
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法:
①
②
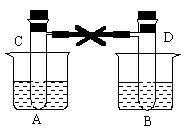
23. 如下图所示,在烧杯A、B中各盛有20℃的水50mL,试管C、D上端用玻璃管和橡皮管相通,试管内充满红棕色气体,它处于平衡状态:2NO2![]() N2O4(正反应放热)。然后用夹子夹住橡皮管。再向A中加入50gNH4NO3(溶于水吸热),向B中加入2gNaOH,使之溶解。
N2O4(正反应放热)。然后用夹子夹住橡皮管。再向A中加入50gNH4NO3(溶于水吸热),向B中加入2gNaOH,使之溶解。
试回答下列问题:
(1)烧杯A中温度 _______,
B中温度 _________。
(2)试管C气体颜色 _____,
D中气体颜色 _______。
(3)已知20℃时NH4NO3的溶解度为192g,则A中的溶液 _____达到饱和。
(4)试比较分别加NH4NO3和NaOH固体后,待气体重新达到平衡后,C、D两试管中混和气体的平均摩尔质量的关系:M(C) M(D)(选填“大于”、“等于”或“小于”)。
24.
(1)NO中混有少量NO2,除去NO2的最好方法是 __________,除去N2中少量O2的方法最好是 ___。
(2)4.8g镁在氧气中燃烧时质量增加3.2g,而相同质量的镁在空气中燃烧时,质量增加却小于3.2g。试分析其原因是 _______________ 。
25. 设在标准状况下做下列实验:
实验I:将盛满氨气的容器,倒立在水中,反应后水面上升至容器几乎完全充满。
实验II:将盛满NO2的容器,倒立在水中,反应后水面上升,最后水充满容器的2/3。
实验III:将盛满NO2和O2的容器,倒立在水中,反应后,水面几乎全充满容器。
试分析上述三个实验,各容器内形成的溶液,其物质的量浓度数值关系,正确的是 (填序号)___________________________
(1)I中的大于II中的 (2)III中的最大 (3)I中的等于II中的 (4)III中的最小
四. 实验题
26. 微型化学实验具有装置小巧、节约药品、操作简便、现象明显、安全可靠、减少污染等特点。下图是某同学设计的NH3催化氧化并检验反应生成的酸性物质的微型装置(图中的铁架台、铁夹等固定装置已略去)。C处装有玻璃纤维和Cr2O3(催化剂)。
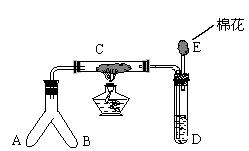
实验中所用试剂不超出下列范围:①NH4Cl和Ca(OH)2的混合物;②浓氨水;③KClO3和MnO2的混合物;④蒸馏水;⑤3%的H2O2和MnO2;⑥NH4HCO3;⑦NaOH溶液;⑧酚酞试液;⑨碱石灰;⑩浓硫酸。试回答下列问题:
(1)微型叉形管中物质A是 ,物质B是 。(填序号)
(2)C处发生反应的化学方程式是 。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是 _,(填序
号)实验过程中的现象是 。
(4)E处的棉花应蘸取的物质 ,其作用为 。
五. 计算题
27. 在一个容积为500mL的密闭容器中,充入5molH2和2molCO。在一定条件下,发生如下反应![]()
![]()
![]() ,经过5min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2mol/L,求:
,经过5min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2mol/L,求:
(1)以H2的浓度变化表示该反应的速率。
(2)达平衡时CO的转化率。
(3)平衡混和气的密度与相同状况下的氢气密度之比是多少?
28. 在0℃和1.01×105Pa时进行下列实验:甲、乙、丙各取30.00mL同浓度的盐酸加入同一镁铝合金产生气体,有关数据如下列表。试求:
(1)盐酸的浓度是多少?
(2)求合金中镁的质量分数。
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |

【试题答案】
一. 二选择题(1—5小题每题2分,6—20小题每题3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | C | C | C | B | A | B | BC | C | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | AB | C | CD | A | B | C | B | BD | B |
三. 填空题(19分)
21.(6分)
(1)3、2=3、2、4
(2)2、1 =2、1、2
(3)2、5、8=5、2、5
22.(2分)① 加入H2O稀释 ② 加入适量的AgNO3 溶液
23.(6分)
(1)下降、升高。
(2)变浅、变深。
(3)未。
(4)大于。
24. (3 分)
(1)通入水中、通过灼热的Cu网 。
(2)镁在空气中燃烧时,同时与少量N2发生反应,等质量的Mg与N2反应的增重小于O2 。
25.(2分)
(3)(4)
四. 实验题(14分)
26.
(1)5,2和9
(2)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(3)7、8,溶液褪色。
(4)7,吸收尾气。
五. 计算题(12分)
27.(6 分)
(1)![]() (2)50% (3)6.6
(2)50% (3)6.6
28.(6分)
(1)![]() (2)47.1%
(2)47.1%
【试卷分析】
此次检测的内容为高二化学第一章氮族元素和第二章化学平衡的基础知识。试卷侧重对平衡知识的考查,难度中等偏上。主要知识包括:氮及其主要化合物的不同价态的转化、过量和多步计算、化学平衡的概念以及平衡移动原理的应用。它们既是高中化学中的重点,也是难点。同学自测后成绩在75分左右属于合格水平。