2006年无锡市部分三星级高中高二第一学期学月考试题
化 学 试 卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。共150分。考试时间为120分钟。第I卷 (总分70)
可能用到的相对原子原子质量:H─1 C─12 N─14 O─16 Na─23 Mg─24 Al─27 Cl─35.5
一.选择题:本题包括10小题,每小题只有一个选项符合题意每题3分。
1. 据报道,月球上存在大量3He,以下有关3He的说法正确的是 ( )
A . 是4He的同分异构体 B. 比 4He少一个中子
C. 比4He少一个质子 D. 3He原子核有3个质子
2. 以下能级符号不正确的是 ( )
A. 3s B. 3p C . 3d D. 3f
3. 下列各原子或离子的电子排列式错误的是 ( )
A. Na+ 1s22s22p6 B. F¯ 1s22s22p6
C . N3+ 1s22s22p6 D. O2¯ 1s22s22p6
4.构造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是
A.E(3s)>E(2s)>E(1s) B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f)
5.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪种原子不能产生NMR现象
A.![]() C
B.
C
B.![]() N C.
N C.![]() O
D.
O
D.![]() P
P
6.下列关于氢原子电子云图的说法正确的是 ( )
A. 通常用小黑点来表示电子的多少,黑点密度大,电子数目大。
B. 黑点密度大,单位体积内电子出现的机会大。
C. 通常用小黑点来表示电子绕核作高速圆周运动。
D. 电子云图是对运动无规律性的描述。
7.下列轨道表示式能表示氮原子的最低能量状态的是 ( )
| ↑↓ |
| ↑ | ↑ | ↑ |
| ↑↓ |
A. 1S 2S 2P
| ↑↓ |
| ↑↓ | ↑ |
| ↑↓ |
B. 1S 2S 2P
| ↑↓ |
| ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
C. 1S 2S 2P
| ↑↓ |
| ↑ |
| ↑↓ |
D. 1S 2S 2P
8.在下列粒子半径的比较中,正确的是( )
A.Na+>Na B.Cl->Cl C.Ca2+>Cl- D.Mg>Na
9.某含氧酸的化学式为HnRO2n+2,试判断R的最合理价态为( )
A. +7 B. +6 C. +5 D.+4
10.几种短周期元素的原子半径及主要化合价见下表:
| 元素符号 | A | B | C | D | E |
| 原子半径(nm) | 0.160 | 0.080 | X | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
则X可能的数值为
A.0.069 B.0.102 C.0.145 D.0.184
二、选择题:本题包括10小题,在每小题给出的四个选项中,最多有2个选项是正确的,每题4分。
11.据报道,上海某医院正在研究用放射性碘(![]() I)治疗肿瘤。该原子的原子核内的中子数与核外电子数之差为( )
I)治疗肿瘤。该原子的原子核内的中子数与核外电子数之差为( )
A.72 B.19 C.53 D.125
12.下列粒子中,与铵离子的质子数和电子数都相等的是( )
A.OH- B.H3O+ C.Ne D.Na
13.下列说法中正确的是
A.所有的电子在同一区域里运动
B.同一原子中,1s、2s、3s所能容纳的电子数越来越多
C.处于最低能量的原子叫基态原子
D.能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动
14. 官能团为羟基(—OH)的有机物为( )
A. CH3COOH B.CH3CH2OH C. C6H5OH D. CH3CHO
15. x 、 y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
A.x的原子半径大于y的原子半径。 B.x的电负性大于y的电负性。
C.x 的氧化性小于y的氧化性。 D.x的第一电离能小于y 的第一电离能。
16.已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以放出氢气。下列叙述正确的是( )
A.LiH的水溶液显中性 B.LiH中的氢离子可以被还原成氢气
C.LiH是一种强氧化剂 D.LiH中氢离子比锂离子的离子半径大
17.下列说法正确的是( )
A、同周期元素原子的第一电离能从左往右越来越大
B、同族元素原子从上到下第一电离能越来越大
C、同周期元素原子的电负性从左往右越来越大
D、同族元素原子从上到下电负性越来越大
18.具有下列特征的原子一定是非金属元素的是( )
A.最外层电子数大于4 B.具有负化合价
C.最高价氧化物对应的水化物是酸 D.具有可变化合价
19.下列气态氢化物中最稳定的是( )
A.H2O B.PH3 C.HF D.NH3
20.下列各对原子序数的原子能以共价键结合成化合物的是( )
A.9和11 B.14和17 C.11和1 D.12和17
第I卷(选择题答案 )
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第II卷(非选择题 共80分)
三. 本题包括3小题,总共15分
21.(3分)液态的植物油经过________可以生成硬化油,天然油脂大多由______ _组成,油脂在________条件下水解发生皂化反应。
22.(5分)淀粉水解生成葡萄糖的反应的化学方程式为:____________________________,为证明淀粉已开始转化为葡萄糖,可加入___________________________进行检验;为证明淀粉已完全水解,可加入_______,现象是不显______。
23.(8分)有①NH2-CH2-COOH ②CH2OH(CHOH)4CHO ③(C6H10O5)n(纤维素)④HCOOC2H5 ⑤苯酚 ⑥HCHO等物质,其中(用数字序号填空):
(1)难溶于水的是_______,易溶于水的是________;
(2)能发生银镜反应的是_______ ;
(3)能发生酯化反应的是____________
(4)能跟氢气发生加成反应的是_______,能在一定条件下跟水反应的是______;
(5)能跟盐酸反应的是______,能跟氢氧化钠溶液反应的是________。
四. 本题包括4小题
24.(6分)某元素的激发态(不稳定状态)原子的电子排布式为1s![]() 2s
2s![]() 2p
2p![]() 3s
3s![]() 3p
3p![]() 4s
4s![]() ,则该元素基态原子的电子排布式为
;元素符号为
;其最高价氧化物对应的水化物的化学式是
。
,则该元素基态原子的电子排布式为
;元素符号为
;其最高价氧化物对应的水化物的化学式是
。
25.(10分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
⑴A在元素周期表中的位置_______________。
⑵A、B、C三种元素形成的简单离子的半径由大到小的顺序是______________。(填写离子符号)
⑶CA2与D元素的单质在水溶液中反应的离子方程式是:
。
⑷C元素常见的化合价有-2、+2、+4、+6等,C与A、B、D均能两两形成各原子(或离子)都满足最外层8电子稳定结构的化合物,请你大胆猜想,写出其中两种化合物的化学式__________、__________。
26.(8分)有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,其中B元素是地壳中含量最多的元素。已知A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的二分之一;C、D、E三种元素的基态原子具有相同的能层数,且E原子的p能级上电子数比D原子的p能级上多一个电子;六种元素的基态原子中,F原子的电子层数最多且和A处在同一主族。回答下列问题:
(1)用电子式表示C和E形成化合物的过程 ;
(2)写出基态F原子的核外电子排布式 ;
(3)用电子式写出A原子与D原子形成A2D分子过程
;
(4)写出E单质与A2B化合物反应的方程式 。
27.(9分) A、B、C三种短周期元素,原子序数依次增大,三种元素数依次之和为35,A、C同族,B+离子核外有10个电子,回答下列问题
①. A、B、C三种元素分别是_________ 、 _________ 、_________。
②. A、B、C之间形成多种化合物,其中属于离子化合物的化学式分别为_________ 、 __________ 、___________。
③分别写出下列微粒的电子排列式:
A._______________________________________
B._______________________________________
C2-._______________________________________
五. 本题包括2小题。
自从1869年俄国化学家门捷列夫将当时已发现的63种元素列成元素周期表后,许多科学家一直致力于元素周期律和周期表的研究。元素周期表揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面都有重要意义。请完成以下关于元素周期表的题目。
28.(8分) 下面是元素周期表的简略框架图。
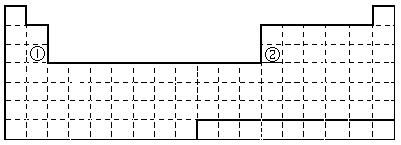
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
按原子核外电子排布,可把元素划分成5个区,不全是金属元素的区为__________。
(2)上表中元素①、②原子的价电子排布式分别为 、 ;
比较元素①与元素②的下列性质(填写“>”或“<”=)
原子半径:①_______②、电负性:①______②、金属性:①______②。
⑶某短周期元素最高正价为+7,其原子结构示意图为_____________。
29.(12分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,回答下列有关问题:
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:___________< X <___________。
② 根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_______________________________________________________________________________; 简述元素电负性X的大小与元素金属性、非金属性之间的关系_________________________________________________________________________________________。
③ 经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是_________________________________________________________________________________________________________。
六. 本题包括1小题.
30.(12分) 化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。
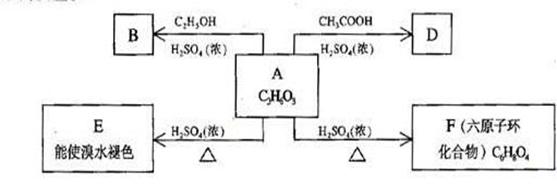
试写出:
化合物的结构简式:A___________________ B_________________
D___________________
化学方程式:A→E_____________________________________
A→F____________________________________
反应类型:A→ E______________,A→F_______________
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | D | C | A | C | B | A | B | A | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | B | CD | BC | B | D | AC | B | C | B |
21.氢化或硬化、高级脂肪酸甘油酯、碱性
22.(C6H10O5)n(淀粉)+nH2O ![]() nC6H12O6(葡萄糖), 银氨溶液或新制氢氧化铜悬浊液, 碘水, 蓝色。
nC6H12O6(葡萄糖), 银氨溶液或新制氢氧化铜悬浊液, 碘水, 蓝色。
23.(1)③④, ①②⑥ ;(2)②④⑥ ,(3)①②③⑤, (4)②⑤⑥ , ③④ (5)①, 145
24. 1s22s22p63s23p4;S;H2SO4。
25.(1)第2周期ⅥA族 (2)S2—>O2—>Na+
(3)SO2 +Cl2+2H2O=4H++2Cl—+SO42— (4)Na2S、SCl2等
26.
(1)![]() (2)1s22s22p63s23p64s1
(2)1s22s22p63s23p64s1
(3) (4)答案略
27.
① O Na S
② Na2O2 Na2O Na2S
③ 0: 1s22s22p4
Na: 1s22s22p63s1
S: 1s22s22p61s23s23p
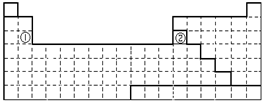 28.⑴ 右表中
28.⑴ 右表中
 s区和p区 (2)3s2 3s23p1
s区和p区 (2)3s2 3s23p1
> < >⑶
29.
①.F 0.8< X <1.2
②.同主族 从上向下,电负性减小;
电负性越大,非金属性越强,金属性越弱,反之亦然
③ 共价键 因为AlCl3中Cl与Al的电负性差值为1.5,小于1.7,则AlCl3的键为共价键。而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值也小于1.7,即AlBr3的键为共价键。
30.CH3-CH-COOH CH3-CH-COOC2H5 CH3-COO-CH-COOH
│ │ │
OH
OH
CH3