| 图象题是化学平衡中的常见题型,是勒沙特列原理等化学平衡知识在直角坐标系中的直观反映。同时,它又是化学平衡的重点、难点,学生的疑惑点、失分点。怎样解决有关图象问题呢?下面将举例讨论。
一、图象题的一般解题思路
这类题目是讨论自变量x(如时间、温度、压强等)与函数值y(如物质的量、浓度、质量分数、转化率)之间的定量或定性关系,因此,要运用数学方法解决此类题目。
1.分析纵横坐标及曲线表示的意义。
2.分析曲线的变化趋势与纵横坐标的关系。
3.分析特殊点(起点、拐点、终点)及其含义。
4.有两个以上变量时,分别讨论两个变量的关系,此时确定其他量为恒量。
二、图象题的类型
1.物质的量(或浓度)—时间图象 | 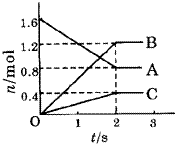
| | 图1 A、B、C三种物质的物质的量随时间变化的关系图 | 例1.某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图1所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。
[分析]这类题目是讨论同一时间段内各物质的变化量的比例关系,且要注意物质的量减少的为反应物,物质的量增多的为生成物。又因物质的量都不变时,反应物、生成物共存,故方程式要用“ ”表示。 ”表示。
[答案]2A 3B+C;0.08mol/(L·s);0.12mol/(L·s)。 3B+C;0.08mol/(L·s);0.12mol/(L·s)。
2.速率—时间图象
例2.把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是_________;t2~t3速率变化的主要原因是_________。 | 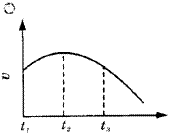
| | 图2 氢气发生速率变化曲线 | [分析] 这类题目是讨论速率受外界条件影响而变化的图象。因速率随时间延长先升高后降低,故速率要受反应过程中物质的浓度、温度(或压强)两种因素变化的影响。
[答案]反应是放热反应,温度升高使化学反应速率提高;盐酸物质的量浓度变小使化学反应速率降低。
例3.某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2+O2 2SO3(正反应放热)的正、逆反应速率的影响如图3所示。 2SO3(正反应放热)的正、逆反应速率的影响如图3所示。 | 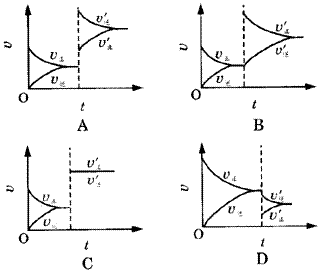
| | 图3 正、逆反应速率的变化曲线 | ①加催化剂对速率影响的图象是( )。
②升温对速率影响的图象是( )。
③增大反应容器体积对速率影响的图象是( )。
④增大O2的浓度对速率影响的图象是( )。
[分析]这类图象是讨论外界条件对化学平衡的影响。解决这类题目的关键是分析改变条件的瞬间,正、逆反应速率的变化及变化幅度。
[答案]①C ②A ③D ④B
3.速率—压强(或温度)图象
例4.符合图象4的反应为( )。
A.N2O3(g) NO2(g)+NO(g) NO2(g)+NO(g)
B.3NO2(g)+H2O(l) 2HNO3(l)+NO(g) 2HNO3(l)+NO(g)
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) 4NO(g)+6H2O(g)
D.CO2(g)+C(s) 2CO(g) 2CO(g) | 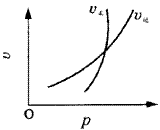
| | 图4 曲线图 | [分析]此类图象中曲线的意义是外界条件(如温度、压强等)对正、逆反应速率影响的变化趋势及变化幅度。
答案 B
4.转化率(或质量分数等)—压强、温度图象
例5.有一化学平衡mA(g)+nB(g) pC(g)+qD(g),如图5所示是A的转化率同压强、温度的关系,分析图5可以得出的正确结论是( )。 pC(g)+qD(g),如图5所示是A的转化率同压强、温度的关系,分析图5可以得出的正确结论是( )。 | 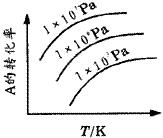
| | 图5 曲线图 | A.正反应吸热,m+n>p+q
B.正反应吸热,m+n<p+q
C.正反应放热,m+n>p+q
D.正反应放热,m+n<p+q
[分析]解决这类图象题目,采用“定一论二”,即把自变量(温度、压强)之一定为恒量,讨论另外两个变量的关系。
答案 A
例6.mA(s)+nB(g) qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图6所示,有关叙述正确的是( )。 qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图6所示,有关叙述正确的是( )。
A.n<q
B.n>q
C.X点,v正>v逆;Y点,v正<v逆
D.X点比Y点反应速率快 | 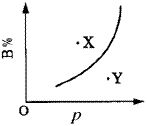
| | 图6 曲线图 | [分析]这类题目中曲线是表示“平衡”时,质量分数与压强(或温度)变化关系曲线。X、Y点则未达平衡状态,反应要向“趋向于平衡状态方向”进行,以此判断某点v正、v逆的大小关系。比较X、Y两点的速率快慢则依据压强的高低(或温度的高低)。
答案 A、C
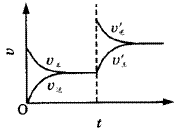
例7.图7表示mA(g)+nB(g) pC(g)+qD(g)+Q,在不同温度下经过一定时间混合体系中C的质量分数与温度T的关系;图8表示在一定条件下达到平衡(v正=v逆)后t时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,判断该反应是( )。 pC(g)+qD(g)+Q,在不同温度下经过一定时间混合体系中C的质量分数与温度T的关系;图8表示在一定条件下达到平衡(v正=v逆)后t时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,判断该反应是( )。 | 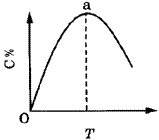
| 
| | 图7 曲线图 | 图8 曲线图 | A.m+n>p+q Q>0
B.m+n>p+q Q<0
C.m+n<p+q Q>0
D.m+n<p+q Q<0
[分析]图7中,生成物的质量分数受同种外界条件的影响呈现两种变化趋势,则这两种趋势一定是平衡前、后的两种情况,故最高点时刚好建立平衡,其后,才为外界条件对平衡的影响。
答案 C
5.质量分数—时间图象
例8.对于可逆反应mA(g)+nB(s) pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图9所示,请判断下列说法正确的是( )。 pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图9所示,请判断下列说法正确的是( )。
A.降温,化学平衡向正反应方向移动
B.使用催化剂可使D%有所增加
C.化学方程式中气体的化学计量数m<p+q
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动
[分析]这类图象的解题方法是“先拐先平”,即曲线先折拐的首先达到平衡,以此判断温度或压强的高低,再依据外界条件对平衡的影响确定答案。 | 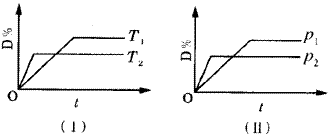
| | 图9 曲线图 | 答案 A、C
以上是常见的几种平衡图象及一般解题思路,具体问题要注意综合、灵活地运用。
例9.反应2X(g)+Y(g) 2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n2)与反应时间(t)的关系如图10所示。下述判断正确的是( )。 2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n2)与反应时间(t)的关系如图10所示。下述判断正确的是( )。 | A.T1<T2,p1<p2
B.T1<T2,p1>p2
C.T1>T2,p1>p2
D.T1>T2,p1<p2 | 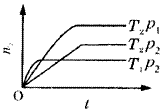 分析 该题要综合运用“定一论二”、“先拐先平”解题;也可依据“定一论二”和外界条件对化学平衡的影响解题。 分析 该题要综合运用“定一论二”、“先拐先平”解题;也可依据“定一论二”和外界条件对化学平衡的影响解题。
答案:C
总之,把握问题实质,正确分析图象意义,灵活运用解题方法是解决图象问题的关键。
| | 图10 曲线图 | | 








 分析 该题要综合运用“定一论二”、“先拐先平”解题;也可依据“定一论二”和外界条件对化学平衡的影响解题。
分析 该题要综合运用“定一论二”、“先拐先平”解题;也可依据“定一论二”和外界条件对化学平衡的影响解题。