2003-2004学年度上学期
高中学生学科素质训练
高二化学同步测试(10)—镁和铝
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
1.用于飞机制造的重要材料是 ( )
A.Mg-Al合金 B.Cu-Sn合金 C.Al-Si合金 D.不锈钢
2.两份铝屑,第一份与盐酸反应,第二份与NaOH溶液反应,产生氢气的体积比为1︰2,则第一份与第二份铝屑的质量比为 ( )
A.1︰1 B.1︰2 C.1︰3 D.2︰1
3.下列物质中,不属于合金的是 ( )
A.硬铝 B.黄铜 C.钢铁. D.水银
4.将相同质量的镁条分别在①氧气中②空气中③氮气中④二氧化碳中完全燃烧,烧后所得固体产物的质量由大到小的顺序是 ( )
A.②﹤①﹤③﹤④ B.④ = ① = ② = ③
C.③﹤②﹤①﹤④ D.③﹤①﹤②﹤④
5.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源
“之一而加以控制。铝在下列使用场合须加以控制的是.①制铝锭 ②制易拉罐 ③制
电线电缆 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用
氢氧化铝制药片治胃病 ⑨制防锈油漆 ( )
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑧
C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
6.向明矾溶液中滴入Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是 ( )
A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在与溶液中
B.一部分为Al(OH)3沉淀,提部分以AlO2-形式存在与溶液中
C.全部以Al(OH)3沉淀 D.几乎全部以AlO2-形式存在于溶液中
7.下列物质中,既能与盐酸反应又能与NaOH溶液反应的是 ( )
①Ca(HCO3)2 ②Al2O3 ③Al(OH)3 ④NaAlO2 ⑤(NH4)2S ⑥Al
A.②③ B.②③⑥ C.①②③⑤⑥ D.全部
8.用稀硫酸、氢氧化钠和铝为原料制取氢氧化铝,甲、乙、丙三学生分别用三种不同途
径制备。 ( )
甲.![]() 乙.
乙.![]()
|
|
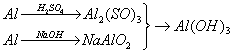
A.乙消耗原料少 B.三者消耗原料相同
C.丙消耗原料最少 D.甲、乙消耗原料相同
9.将等物质的量的镁和铝相混合,取四份等质量的该混合物分别加到足量的下列溶液中,
充分反应后,放出氢气最多的是 ( )
A.3 mol/L HCl B.4 mol/L HNO3
C.8 mol/L NaOH D.18 mol/L H2SO4
10.MgCl2·6H2O在高温灼烧时,其分解产物为 ( )
A.MgCl2和H2O B.Mg(OH)2、HCl和H2O
C.Mg、Cl2和H2O D.MgO、HCl和H2O
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
11.现代建筑的门窗框架,常用电解加工成古铜色的硬铝制造。取硬铝样品进行如下实验:(已知锰比铁活动)
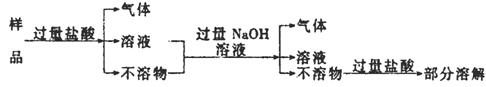
由此推知硬铝的组成是
A.Al、Mg、Si、Zn B.Al、Cu、Mg、Si、Mn
C.Al、Fe、C.Cu D.Al、Si、Zn、Na
12.新买的铝锅、铝壶用来烧开水时,凡是水浸到的地方都会变成黑色,这与水中含有下列可溶盐有关的是 ( )
A.钠盐 B.钾盐 C.钙盐 D.铁盐
13.某溶液中溶有MgCl2和AlCl3两种溶质,若把二者分离开,应选用下列各组试剂中的
( )
A.NaOH溶液和氨水 B.氨水和盐酸
C.NaOH溶液和盐酸 D.盐酸和稀硫酸
14.将两份质量相等的铝粉,分别加入足量的氢氧化钠和足量的稀硫酸溶液中,则它们放出的气体(相同条件下)的体积比为 ( )
A.1∶1 B.1∶2 C.1∶3 D.2∶3
15.下列各组溶液,无论将少量前者滴入后者,还是将少量后者滴入前者,生成物一定相同的是 ( )
A.AgNO3溶液和NH3·H2O B.FeBr2溶液和氯水
C.NaOH溶液和AlCl3溶液 D.Ca(HCO3)2溶液和澄清石灰水
16.1mol NA.Mg、Al分别与100mL 5.0mol·L-1的盐酸充分反应,所得的气体在同温同压下的体积关系正确的是 ( )A.相同 B.铝最多,钠最少
C.铝最多,镁和钠相同 D.钠最多,镁、铝相同
17.向2.5g KAl(SO4)2固体中加入300mL 0.1mol·L-1的Ba(OH)2溶液,充分反应后所得沉淀的质量为 ( )
A.0.78g B.2.33g C.4.66g D.5.44g
18.下列反应的离子反应方程式正确的是 ( )
A.二氧化碳通入碳酸钠溶液中:![]()
B.氯气通入冷的氢氧化钠溶液中:![]()
C.硫酸亚铁溶液加入过氧化氢溶液![]()
D.适量的稀硫酸滴入偏铝酸钠溶液中![]()
19.近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是 ( )
A.![]()
B.![]()
C.![]()
D.![]()
20.甲、乙两烧瓶中各盛有100mL 3mol·L-1的盐酸和氢氧化钾溶液,向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲:乙=2∶3(相同状况),则加入铝粉的质量为 ( )
A.2.7克 B.3.6克 C.5.04克 D.4.05克
21.将3.9g镁铝合金,投入到500mL2mol·L-1的盐酸中,金属完全溶解,再加入4mol·L-1的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是 ( )
A.125mL B.200mL C.250mL D.560mL
22.把Al和Fe3O4粉配成铝热剂,分成两等份,前一份在高温下恰好完全反应,然后将生成物与足量的盐酸充分反应,后一份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成气体的物质的量之比为 ( )
A.1︰3 B.9︰8 C.3︰4 D.4︰3
三、填空题 ( 共6小题、共32分)
22.(6分)点燃镁条在SO2中像在CO2中那样能够燃烧,但反应较镁和CO2反应更为剧
烈,反应结束后,在盛有SO2的广口瓶中可能存在的生成物是_________________
(写出化学式),反应的化学方程式是_______________________________________.
____________________________________________________________
23.(5分)有A.B.C.D.E五种化合物,其中A.B.C.D是铝元素的化合物。F是一
种气体,标况下对空气的相对密度为1.103。有下列反应.
① A + NaOH
→ D + H2O ②B ![]() A + H2O
A + H2O
③C + NaOH(适量)→B + NaCl, ④E + H2O →NaOH + F。则
化学式分别为 A._______ B._________
C.___________ D._________ E.______
24.(5分)下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量从
A— E中选择各题要求的序号填入表中
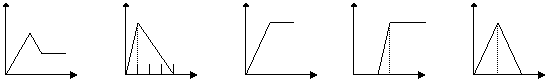
A B C D E
| 溶液 | 加入的物质 | 答案序号 |
| 饱和石灰水 | 通CO2至过量 | |
| AlCl3溶液 | 通过量的NH3 | |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | |
| NaAlO2溶液 | 滴加稀HCl至过量 | |
| MgCl2 AlCl3的混和液 | 滴加NaOH至过量 |
25.(8分)光卤石(KCl·MgCl2·6H2O)样品中含有不跟NaOH溶液,盐酸反应的杂质.某校化学课外活动研究小组现欲测定此样品中含KCl·MgCl2·6H2O的质量分数,经讨论有多种实验测定方案.
请根据提供的实验试剂和仪器(所需的仪器任选),选择精确度较高的实验测定方案,简要写出第二步以后的实验步骤和实验结果.
一、可选用的实验试剂:
(1)a mol·L-1NaOH溶液 (2)b mol·L-1Na2CO3溶液 (3)c mol·L-1HCl溶液
(4)d mol·L-1AgNO3溶液 (5)酚酞试液 (6)甲基橙试液
二、实验步骤:
第一步:称取mg 样品,放入250ml烧杯中,加适量水溶解
第二步:……
计算样品中含KCl·MgCl2·6H2O(式量为277.5)的质量分数表达式:_________________
26.(8分)实验室欲用下列装置和药品来制备少量的氮化镁
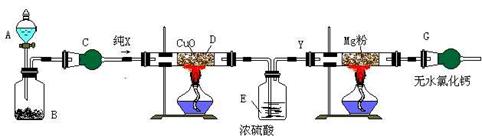
上图的实验装置中,A中是浓氨水,B中是生石灰,C中是干燥剂。试通过分析回答.
⑴在装置B中生成X气体的化学方程式._____________________________________
⑵装置C中应当选用的干燥剂是._______________________________
⑶写出D装置中发生反应的化学方程式._____________________________________
⑷装置E和G的作用分别是.________________________________________________
四、计算题(每小题12分)
27.取一根镁条置于坩埚内点燃,得到氮化镁和氧化镁混合物,总质量为0.470g,冷却
后加入足量的水,将反应物加热蒸干并灼烧,得到的氮化镁的质量为0.486g.
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学方程式。
(2)计算燃烧所得混合物中氮化镁的质量分数。
参考答案
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | B | D | C | C | D | C | C | A | D |
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | D | C | A | D | D | C | AD | C | D |
| 21 | 22 | ||||||||
| C | C |
三、填空题
23、S或MgS;2Mg + SO2 = 2MgO + S;Mg + S = MgS
24、E、C、D、B、A
25(详解)
1、 由条件找关系
可能的离子反应:
①Mg2++2OH-=M(OH)2↓ ②Mg2++CO32-=MgCO3↓ ③Ag++Cl-=AgCl↓
分别与KCl·MgCl2·6H2O可能构成的关系式有:
2OH -→Mg2+→M(OH)2→KCl·MgCl2·6H2O
CO32-→Mg2+→MgCO3↓→KCl·MgCl2·6H2O
Ag+→Cl-→AgCl↓→1/3KCl·MgCl2·6H2O
由上述关系可见,求KCl·MgCl2·6H2O的量,可从所加试剂的量入手,也可用生成沉淀的质量的进行计算来求得。
2、由实验操作的难易确定最佳途径
①测定沉淀的质量:需要过滤、洗涤、烘干,步骤多误差较大②测定所加试剂的量:可通过滴定法,精确度较高,操作较简便。由此可见,方法②为最佳途径。
3、再由细节,求完善
⑴为了使沉淀完全,沉淀剂必须过量;过量的试剂必须准确测出,涉及的实验步骤要尽可能少。
⑵中和滴定中指示剂的选择也很关键。仅仅从中和反应本身来讲,甲基橙、酚酞皆可用,但在此实验中影响到实验操作的难易。如选甲基橙作滴定过量碱的指示剂,就必须对生成的Mg(OH)2沉淀进行过滤、洗涤且将洗涤液合并后,再进行滴定;如选酚酞试液作指示剂,Mg(OH)2沉淀就无需过滤,因为酚酞变色范围在pH=8~10,滴定到终点时Mg(OH)2沉淀不会溶解。显然,用酚酞作指示剂简化了实验步骤,提高了实验的精确度,所以应选用酚酞作为测定过量的NaOH 的指示剂。
综合1、2、3的分析具体解答如下:
(第一步题中已定)
第二步:加入A mL a mol·L-1NaOH溶液(过量),充分反应;
第三步:直接在反应后的溶液中滴加酚酞指示剂2~3滴
第四步:用c mol·L-1HCl溶液滴定至由浅红色为无色止。消耗HCl 溶液B mL