**中学2005学年第一学期高二年级第三次过关测试
化 学(普通班) 2005/12/14
注意事项:
1.本试卷分试卷Ⅰ和试卷Ⅱ两部分。
2.答案必须做在答题卷上,做在试题卷上的无效。
试 卷 I
一.选择题(每小题只有一个正确答案,每小题2分,共50分)
1.下列金属与等浓度的盐酸反应,反应速率最快的是
A.Mg B.Al C.Fe D.Hg
2.常温下,等质量的金属铝,与足量下列物质反应,产生氢气的物质的量最多的是
A.稀HNO3 B.浓H2SO4 C.NaOH溶液 D.H2O
3.下列说法不正确的是
A.由于Al的金属性比较强,所以工业上冶炼铝,一般采用电解法
B.常温下浓硝酸可用铝制容器贮存
C.利用铝热反应可以冶炼某些难熔的金属
D.Al原子能失去3个电子,比Mg原子能失去的电子多,所以金属性Al强于Mg
4.下列反应中,能通过置换反应得到Fe的是
A.CO通入Fe2O3(高温) B.H2通入FeSO4溶液
C.Al与Fe3O4(高温) D.Cu加入FeCl3溶液
5.将过量的铁粉加到CuSO4溶液中,充分反应。下列说法,不正确的是
A.铁粉是还原剂,CuSO4是氧化剂
B.固体质量减轻,溶液质量增重
C.溶液颜色由蓝色变为线绿色
D.固体表面产生红色物质
6.只用一种试剂,可区别Na2SO4、MgSO4、AlCl3、NH4Cl四种溶液,这种试剂是:
A.HCl B.BaCl2 C.AgNO3 D.NaOH
7.两份铝,一份加入足量强碱液,一份加入足量盐酸中,要使前后反应收集到的氢气量之比为1︰2,则两份铝质量比为
A.1︰2 B.2︰1 C.1︰4 D.1︰1
8.下列物质不能由单质直接化合而成的是
A.Al2S3 B.FeCl2 C.FeS D.MgCl2
9.金属铝与盐酸反应时,加入少量下列固体时,生成氢气的速率会加快的是
A.CH3COONa B.NaOH C.KNO3 D.CuSO4
10.冶炼金属常用以下几种方法:①以C或CO、H2作还原剂还原;②电解法;③热分解法。现冶炼金属Na、Fe、Hg,试选出这三种金属的适宜冶炼方法
A.①③② B.①②③ C.②①③ D.③②①
11.向含有NH4+、Mg2+、Fe2+和Al3+的溶液中加入足量Na2O2微热并搅拌后,再加入过量稀盐酸,溶液中大量减少的离子是
A.NH4+ B.NH4+、Fe2+ C.Al3+、Mg2+ D.Al3+
12.下列离子可以大量共存的是
A.Fe2+、NO3—、SO42—、H+ B.Al3+、AlO2—、Cl—、K+
C.Mg2+、NO3—、Cl—、H+ D.Fe 3+、Al3+、SCN—、OH—
13.欲除去Fe2(SO4)3 溶液中的少量FeSO4杂质,加入下列物质最佳的是
A.H2O2 B.铁粉 C.氯水 D.H2SO4
14.下列离子方程式书写正确的是
A.Cu+Fe3+=Fe2++Cu2+ B.Al+3OH—=Al(OH)3↓
C.氧化镁与稀盐酸反应:MgO+2H+=Mg2++H2O
D.氯化铝溶液中加入足量氨水:Al3++4OH—=AlO2—+2H2O
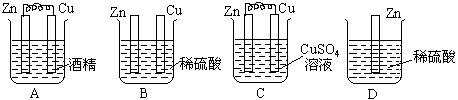
15.下列装置中,能组成原电池的是
16.把a、b、c、d四块金属片浸入稀硫酸,分别用导线两两连接可以组成原电池。a、b相连时,a为负极;c、d相连时,电流方向为d→c;a、c相连时,c极产生大量气泡;b、d相连时,d极上发生氧化反应。这四种金属的活动性由强到弱的顺序是
A.abcd B.acdb C.cabd D.bdca
17.把已经点燃的镁条放入下列气体中,会熄灭的是
A.SO2 B.CO2 C.Ar D.O2
18.下列说法不正确的是
A.合金的熔点一般比组成该合金的任何金属的熔点都来得低
B.明矾可用作净水剂
C.镀锌铁比镀锡铁在镀层破坏之后铁更容易被腐蚀
D.金属一般是电的良导体
19.某物质在氧气中完全燃烧后,生成物只有二氧化碳和水,以下说法正确的是
A.该物质只含有碳元素和氢元素
B.该物质只含有碳元素和氧元素
C.该物质一定含有碳元素、氧元素、氢元素
D.该物质一定含有碳元素和氢元素,可能含有氧元素
20.光照条件下将等物质的量的甲烷与氯气充分反应,得到的混合物中物质的量最多的是
A.CCl4 B.CH2Cl2 C.CH3Cl D.HCl
21.下列叙述中不正确的是
A.C60与石墨是同素异形体 B.H(氕)、D(氘)、T(氚)互为同位素
C.正戊烷和2-甲基丁烷是同系物 D.正丁烷与2-甲基丙烷互为同分异构体
22.下列物质中属于有机物的是
A.CO2 B.CCl4 C.KHCO3 D.NH3
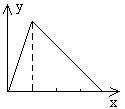 23.向A溶液中逐滴加入B溶液(或气体)直至过量,产生沉淀的质量
23.向A溶液中逐滴加入B溶液(或气体)直至过量,产生沉淀的质量
(y轴)与B物质的质量(x轴)有如图关系。下列组合中,正确的是
A.AlCl3溶液、NaOH溶液 B.NaAlO2溶液、稀盐酸
C.Ca(OH)2溶液、CO2气体 D.H2SO4溶液、Ba(OH)2溶液
24.既能与盐酸反应,又能与氢氧化钠溶液反应的化合物是
①AgNO3 ②Al(OH)3 ③NH4HCO3 ④NaAlO2 ⑤Al2O3
A.①②③⑤ B.②③④⑤ C.①②④⑤ D.②⑤
25.现有10.2g镁和铝的混和粉末溶于4mol/L的盐酸500mL中。若加入2mol/L的氢氧化钠溶液,要使产生的沉淀的质量最大,则需加入的氢氧化钠溶液的体积为
A.100mL B.500mL C.1000mL D.1500mL
试 卷 II
二.填空题(本题有6小题,共42分)
26.(2分)写出甲基的电子式:
27.(8分)分子组成为C5H12的同分异构体有:
(写结构简式),上述同分异构体中其一氯取代物只有一种的是 (写名称)。
28.(5分)生铁(含碳)在潮湿的空气中很容易生锈,是因为发生了 腐蚀,写出电极反应式,正极: ;负极
29.(8分)某化工厂生产中要用到一种无色、可溶于水的晶体——铝铵矾,该晶体是一种复盐,其主要化学成分是硫酸铝铵——NH4Al(SO4)2,向该盐的浓溶液中加入浓KOH溶液,将发生一系列变化,已知NH4+和AlO2—不能大量共存,会发生反应:
NH4++ AlO2—+H2O==Al(OH)3↓+NH3,试求:
A.硫酸铝铵在水中电离的方程式:
B.在逐渐加入浓KOH溶液的过程中,产生的现象依次是:
① 溶液中出现白色沉淀,白色沉淀量逐渐增多
② 有刺激性气味的气体放出
③ 白色沉淀量逐渐减少,白色沉淀完全消失
请依次写出滴入KOH溶液过程中发生的化学反应的离子方程式:
①
②
③
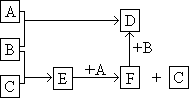 30.(10分)A、B、C均为单质,B是黄绿色气体,B与C反应后的产物 溶于水得到无色溶液E。B、F、D、E的水溶液均呈酸性, A、B、C之间的其它反应如右图所示:
30.(10分)A、B、C均为单质,B是黄绿色气体,B与C反应后的产物 溶于水得到无色溶液E。B、F、D、E的水溶液均呈酸性, A、B、C之间的其它反应如右图所示:
(1)写出各物质的化学式。
A 、B 、C
(2)D呈酸性的原因,用离子方程式表示
(3)A单质与D溶液反应的离子方程式为
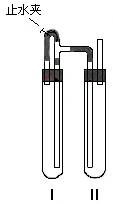 31.(10分)为制得白色的Fe(OH)2沉淀,采取了如右图的装置,使用了NaOH溶液、铁屑、稀H2SO4等试剂制备。
31.(10分)为制得白色的Fe(OH)2沉淀,采取了如右图的装置,使用了NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管I里加入的试剂是 。
(2)在试管II里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开 止水夹,塞紧塞子后的实验步骤是
。
(4)若生成的白色Fe(OH)2沉淀接触外界的空气,容易发生的反应的化学方程式为 。
(5)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
三.计算题(本题共7分)
32.现有某镁铝合金的粉末样品,平均分成两份,其中一份加足量的NaOH溶液,产生标准状况下氢气的体积为3.36L,另一份加入足量的稀盐酸,产生标准状况下氢气的体积为4.48L。求原样品中Mg的质量。
**中学2005学年第一学期高二年级第三次过关测试答题卷
化 学(普通班) 2005/12/ 14
14
一.选择题(每小题2分,共50分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | ||||||||||||
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
二.填空题(共43分)
26.(2分)
27.(8分) 、 、
(写结构简式), (写名称)。
28.(5分) ,
正极: ;负极
29.(8分)A.
①
②
③
30.(10分) A 、B 、C
(2)
(3)
31.(10分)(1)
(2)
(3)
(4)
(5)
三.计算题(共7分)
32.解:
**中学2005学年第一学期高二年级第三次过关测试答案
化 学(普通班)2005/12/14
一.选择题(每小题2分,共50分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | A | C | D | C | B | D | A | B | D | C | B | C |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| A | C | C | B | C | C | D | D | C | B | B | A | C |
二.填空题(共43分)
26.(2分)甲基的电子式略
27.(8分)C5H12的三种同分异构体的结构简式略,2,2-二甲基丙烷或新戊烷
28.(5分) 电化学腐蚀或者吸氧腐蚀,
正极:O2+2H2O+4e—=4OH—;负极:2Fe-4e—=2Fe2+
29.(8分)A.NH4Al(SO4)2 = NH4++ Al3++2SO42—
①Al3++3OH—=Al(OH)3↓
②NH4++OH—= H2O+NH3↑
③Al(OH)3+OH—=AlO2—+2H2O
30.(10分)(1)A、Fe B、Cl2 C、H2
![]()
![]()
![]() (2)Fe3++3H2O Fe(OH)3+3H+
(2)Fe3++3H2O Fe(OH)3+3H+
![]() (3)2Fe3++Fe=3Fe2+
(3)2Fe3++Fe=3Fe2+
31.(10分)(1)稀H2SO4和铁屑
(2)NaOH溶液
(3)检验试管II出口处排出氢气的纯度。当排出的氢气纯净时,再夹紧止水夹
(4)4Fe(OH)2+2H2O+O2=4Fe(OH)3
(5)试管I中生成的H2充满了试管I和试管II,且外界空气不容易进入
三.计算题(共7分)
32.2.4g