福州市2005-2006学年第一学期期末质检
高二化学(理科)综合练习
(完卷时间:120分钟;满分:100分)
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得分 | ||||||
| 评卷人 |
可能用到的相对原子质量:H-1、N-14、S-32、Na-23、Mg-24、Al-27、O-16、Fe-56、Cu-64、Ba-137
(Ⅰ卷 共50分)
一、选择题:(下列各题只有一个选项符合题意。每小题2分,共50分)
1.下列各组物质不属于同素异形体的是( )
A.35Cl和37Cl B. O2和O3 C.金刚石和C60 D.白磷和红磷
2.下列化合物中,可以通过相应的单质直接化合而成的是( )
A. H2SO4 B. FeCl2 C.Al2S3 D.CuS
3.下列物质中,属于强电解质的是( )
A.HClO B.KHCO3 C.HF D.H2SO3
4.在铜跟稀硝酸的反应中,被还原的硝酸与未被还原的硝酸的物质的量之比为( )
A.1:2 B. 1:1 C.1:4 D. 1:3
5.工业上,通常用电解的方法冶炼的金属是( )
A.Fe、Al B.Na、Al C.Cu、Ag D.Al、Zn
6.用铝热法从下列氧化物中还原出物质的量相同的各金属,耗铝最多的是( )
A.Cr2O3 B.WO2 C.MnO2 D.V2O5
7.五氧化二磷不仅是一种强干燥剂,而且有很强的脱水性,向浓硝酸中加入过量的P2O5,能生成一种含氮化合物M,则M最可能是( )
A.NO2 B.N2 C.NO D.N2O5
8.将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A.c(HCN)<c(CN-) B.c(Na+)<c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D.c(HCN)+c(CN-)=0.1mol/L
9.下列物质的存放方法正确的是( )
A.白磷贮存在密闭容器中,少量白磷保存在水中
B.硝酸盛放在有橡皮塞的棕色瓶里,存放在黑暗且温度低的地方
C.氯水保存在无色试剂瓶中
D.可用铝制的槽车装运浓硝酸和稀硝酸
10.在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.单位时间内生成 n mol A,同时生成 3n mol B B.A、B、C的浓度不再变化
C.A的生成速率与C 的生成速率相等 D.A、B、C的分子数之比为 1∶3∶2
11.下列离子组能够大量共存于溶液中的是( )
A.Al3+、K+、AlO2-、Cl- B.Fe2+、H+、NO3-、SO42-
C.K+、Ba2+、SO42-、Cl- D.Mg2+、Ba2+、Cl-、Br-
12.在一定条件下,发生 CO+NO2 ![]() CO2+NO的反应,达到化学平衡后降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是( )
CO2+NO的反应,达到化学平衡后降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是( )
A.正反应是吸热反应 B.正反应是放热反应
C.降温后CO的浓度增大 D.降温后各物质的浓度不变
13.铁钉与碳棒用导线连接后,同时浸入0.01mol·L-1的NaCl溶液中,可能发生的反应是( )
A.碳棒上放出氯气 B.碳棒附近产生OH—
C.碳棒上放出氧气 D.铁钉被还原
14.0.1mol/L的氨水在稀释过程中,始终保持增大趋势的是( )
A.c(NH4+) B.c(OH-) C.n(NH4+) D. c(H+)
15.不能证明醋酸是弱电解质的事实是( )
A.中和1L0.1mol/L的CH3COOH 溶液需要0.1mol/L NaOH溶液1L
B.0.1mol/L CH3COONa溶液的pH大于7
C.pH=3的CH3COOH 溶液加水稀释到原体积的10倍时,pH小于4
D.0.1mol/L的CH3COOH的pH=3
16.0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,离子浓度大小正确次序( )
A. c(Na+)> c(Cl-)> c(OH-)> c(H+) B. c(Na+)= c(Cl-)> c(OH-)> c(H+)
C. c(Na+)= c(Cl-)> c(H+)> c(OH-) D. c(Cl-)>c(Na+)> c(OH-)> c(H+)
17.将物质的量相等的硫酸铝和硫酸铵溶水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )
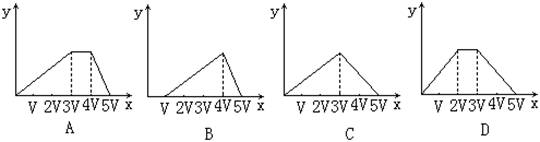
18.有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A. V3>V2>V1 B. V3=V2=V1 C. V3>V2=V1 D. V1=V2>V3
19.用标准浓度的NaOH溶液来滴定未知浓度的盐酸,在下列操作中,会使盐酸测定浓度偏高的是( )
⑴碱式滴定管用蒸馏水洗净后未用标准溶液润洗
⑵锥形瓶中盛有少量蒸馏水,再加待测液
⑶移液管用蒸馏水洗净后,未用盐酸润洗
⑷滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑸滴定后观察滴定管读数时,视线高于刻度线
A.⑵⑶ B.⑴⑶ C.⑴⑷ D.⑷⑸
20. 95℃时,纯水中的 H+ 的物质的量浓度为1×10-6 mol·L-1 ,若把 0.01 mol NaOH固体溶解在95℃水中配成 1 L溶液,则溶液的 pH 为( )
A.2 B.4 C.10 D.12
21.某原电池总反应的离子方程式为 2Fe3+ +Fe = 3Fe2+ ,可以实现上述反应的原电池是( )
| 正 极 | 负 极 | 电解质溶液 | |
| A | C | Cu | Fe2(SO4)3 |
| B | Ag | Fe | FeCl3 |
| C | Cu | Fe | CuSO4 |
| D | Fe | Zn | Fe2(SO4)3 |
22.漂白粉溶液中存在下列平衡ClO-+H2O![]() HClO+OH-下列措施不能提高其漂白效果的是( )
HClO+OH-下列措施不能提高其漂白效果的是( )
A.加入少量氢氧化钠 B.通入过量二氧化碳
C.加入适量稀盐酸 D.加少量冰醋酸
23.下列离子方程式中,正确的是( )
A.硫酸亚铁溶液与过氧化氢溶液混合 ![]()
B.小苏打溶液与稀硫酸混合 ![]()
C.大理石溶解于醋酸 ![]()
D.明矾溶液加热水解生成沉淀 ![]()
24.根据酸碱质子理论:凡是能给出质子(即氢离子)的分子或离子都是酸;凡是能结合质子的分子或离子都是碱。按照此理论,下列粒子属于两性物质的是( )
A.NO2- B.HN03 C. H2PO4- D.NH4+
25.有5.1g镁、铝合金,投入500mL 2 mol/L盐酸溶液后,金属全部溶解后,再加入4 mol/L NaOH溶液,若要达到沉淀最大值,则加入NaOH溶液的体积应为( )
A.250mL B.425mL C.500mL D.560mL
(Ⅱ卷 50分)
二.填空题(共16分)
26. (8分) 向纯碱溶液中滴入酚酞溶液,观察到的现象是______________,原因是(用离子方程式表示)
______________________________________________________;若再向该溶液中滴入过量氯化钙溶液,观察到的现象是__________________________,原因是_______________________________________。
27 (8分).今有①CH3COOH、②HCl、③H2SO4 三种溶液,用序号回答下列问题
(1)当它们pH相同时,其物质的量浓度的由大到小排列是 。
(2)当它们的物质的量浓度相同时,其pH的由大到小排列是 。
(3)中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为 。
(4)体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液pH为7,所需烧碱溶液的体积关系为 。
三、推断题(16分)
28(8分).右图是某元素及其重要化合物的相互转化关系图(生成物中不含该元素的物质均已略去),图中A是单质,D在常温下呈气态,E可用作化肥,也可用来作炸药。
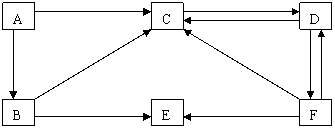 |
(1)写出A的电子式 ;B分子的结构呈 ;
(2)写出下列变化的化学方程式:
B→C:____________________________________________________________;
F→C:____________________________________________________________。
29(8分).有一无色透明的溶液做如下实验:
(1)取少量溶液滴加盐酸酸化的BaCl2溶液,有白色沉淀生成。
(2)另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示:
试问:
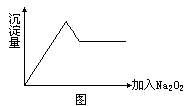
![]() 等离子中一定存在的离子是
;可能存在的离子是
;一定不存在的离子是
。
等离子中一定存在的离子是
;可能存在的离子是
;一定不存在的离子是
。
(2)上述溶液至少由 等物质混合成。
四、实验题(11分)
30(3分).现只有酚酞试液、试设计鉴别盐酸、氢氧化钠、硫酸钠三瓶溶液的实验方案:
。
31.(8分)氨(NH3)是重要的含氮化合物。1774年该气体由英国普里斯特里利用熟石灰和氯化铵加热反应制成。
(1)写出实验室制取氨气的化学方程式 ;
(2)为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置:
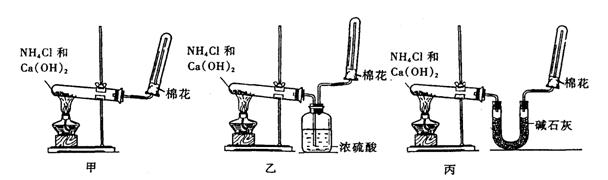
实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”) ;
(3)如何检验氨气是否收集满(简述操作方法、现象和结论) ;
(4)该实验装置与实验室制备 气的装置相同.;
五、计算题(7分)
32(7分).有一硫酸和硝酸的混合溶液,取出20mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得沉淀9.32g;滤液与4mol/L的苛性钠溶液35mL恰好完全中和。试求:
⑴.原混合溶液中硫酸和硝酸的物质的量浓度。
⑵.另取20mL原溶液,加入3.2g铜粉共热,生成气体一氧化氮的体积。(标准状况下)。
【参考答案与评分标准】
一、选择题:(下列各题只有一个选项符合题意。每小题2分,共50分)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | A | C | B | D | B | D | D | D | A | B | D | B |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| B | B | A | C | A | C | C | C | B | A | D | C | A |
二.填空题(共16分)
26. (各2分,共8分)
溶液显红色,
碳酸钠水解(或答![]()
![]()
![]() )溶液呈碱性,使溶液显红色,
)溶液呈碱性,使溶液显红色,
产生白色沉淀,且溶液的红色褪去,
加入CaCl2后,![]() 使水解平衡向左移动,
使水解平衡向左移动,![]() 离子浓度减少,使溶液褪色。
离子浓度减少,使溶液褪色。
27(8分).
(1)① > ②> ③。
(2)③ > ②> ①。
(3)① = ② > ③。
(4)③ > ②> ①。
(各2分,共8分)
三、推断题(16分)
|
(2)B→C: 4NH3 + 5O2 ==== 4NO + 6H2O;(无条件或未配平均不给分)
F→C: 3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑ + 4H2O。
(写“加热”条件或未标“↑”符号不扣分;未配平不给分)
29. (每空2分,共8分)
(1)![]()
![]()
![]()
(2)硫酸镁和硫酸铝。
四、实验题(11分)
30(3分).
各取少量未知溶液分别装在三支试管中,各滴加2~3滴酚酞试液,溶液变红色的是氢氧化钠溶液;再将上述红色溶液分别倾倒少许到另两支试管,能使红色褪去的原溶液是盐酸;不能使红色褪去的原溶液是硫酸钠溶液。
31.(8分)(1)2NH4Cl
+ Ca(OH)2 ![]() CaCl2 + 2NH3↑+ 2H2O;
CaCl2 + 2NH3↑+ 2H2O;
(2)丙;
(3)将蒸馏水湿润的红色石蕊试纸放在试管口,若试纸变蓝说明NH3已收满;
(4)氧气。
(每空2分,共8分)
五、计算题(7分)
32(7分)(步骤略)
(1)C(HNO3)=3mol/L(2分)
C(H2SO4)=2mol/L(2分)
(2)0.75L(3分)