第二学期高二期末化学试卷
第I卷(选择题共 83分)
可能用到的原子量:H l C 12 N 14 O 16 Na 23 Mg 24 Al 27 Cl 35.5 S 32 P 31
一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意。)
1.我国某些城市和地区严格禁止生产和销售含磷洗涤剂。含磷洗涤剂主要是添加了三聚磷酸钠,禁止使用的原因是
(A)三聚磷酸钠会引起白色污染
(B)三聚磷酸钠会跟硬水中的Ca2+、Mg2+形成沉淀堵塞下水管道
(C)三聚磷酸钠会造成自然水质的富营养化,使水生植物大量繁殖,水质变坏
(D)三聚磷酸钠价格昂贵,使用成本高
2.1995年美国教授Lagow报道,他制得了碳的第四种同素异形体——链式炔碳:…-C≡-C≡C-C≡C—…。该物质的一个分子中含300—500个碳原子,性质很活跃。据此判断链式炔碳的熔点,估计比金刚石
A.高 B.低 C.相等 D.无法判断
3.化学实验室中常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A.定性检验SO32-,将BaCl2溶液用HNO3酸化
B.为提高高锰酸钾溶液的氧化能力,用盐酸将KMnO4溶液酸化
C.检验溶液中是否含有Fe2+时,用硝酸酸化
![]()
所加的BaCl2溶液用盐酸酸化
4.下列电子式书写正确的是[ ]

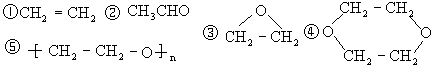 |
5.二氧化氮存在下列平衡:2NO2(气)
A.温度130℃、压强3.03×105Pa
B.温度25℃、压强1.01×105Pa
C.温度130℃、压强5.05×104Pa
D.温度0℃、压强5.05×104Pa
二、选择题(本题包括12小题,每小题3分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
6.下列选项中所述的两个量,前者一定大于后者的是 [ ]
A.纯水在80℃和25℃时的pH
B.硬脂酸和软脂酸的熔点
C.zX和(z+2)X的原子半径
D.苯分子和环己烷分子中碳碳键的键长
7.设NA表示阿伏加德罗常数。下列说法不正确的是[ ]
![]()
B.在2L0.5mol·L-1AlCl3溶液中Al3+数目为NA个
C.在1L0.5mol·L-1的Na2CO3溶液中,离子总数一定大于1.5NA个
D.1molH2O2与MnO2充分作用下,转移的电子总数为NA个
8.关于晶体的下列说法正确的是[ ]
(A)只要含有金属阳离子的晶体就一定是离子晶体
(B)离子晶体中一定含有金属阳离子
(C)在共价化合物分子中,各原子都形成8电子结构
(D)分子晶体的熔点不一定比金属的晶体熔点低
9.下列说法正确的是 [ ]
A.0.2mol·L-1的NaHCO3溶液中:[Na+]>[HCO3-]>[CO32-]>[OH-]
B.向NH4Cl溶液中加入少量氨水,当pH=7时,则混合液中:[NH4+]=[Cl-]
C.0.1mol·L-1的Na2S溶液中:[Na+]=2[S2-]
D.0.1mol·L-1的乙二酸溶液的pH>1,则等体积、等浓度的乙二酸溶液与NaOH溶液混合,溶液的pH>7
10.在pH=0无色透明溶液中,因氧化还原反应而不能大量共存的离子组是
![]()
![]()
11.已知乙烯醇(CH2=CHOH)不稳定,可自动转化为乙醛;二元醇可脱水生成环状化合物。现有1mol乙二醇在一定条件下脱去1mol水,所得产物的结构简式有下列几种,其中不可能的是
(A)只有① (B)只有①④ (C)只有①⑤ (D)有①④⑤
12.下列离子方程式书写正确的是[ ]
A.向碳酸氢钠溶液中滴加少量氢氧化钡溶液
![]()
B.向碳酸氢镁溶液中加足量的氢氧化钠溶液
![]()
C.Ca(ClO)2溶液中通入过量的二氧化硫气体
Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
D.向烧碱溶液中滴加少量氯化铝溶液
Al3++4OH-=AlO2-+2H2O
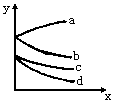 13.有等体积、等物质的量浓度的氢硫酸、亚硫酸溶液各两份,分别各通入C12、O2,溶液的pH(y)与通入气体的量(x)的关系如图所示。则a、b、c、d能代表pH变化的反应正确的是:[ ]
13.有等体积、等物质的量浓度的氢硫酸、亚硫酸溶液各两份,分别各通入C12、O2,溶液的pH(y)与通入气体的量(x)的关系如图所示。则a、b、c、d能代表pH变化的反应正确的是:[ ]
A.a为氢硫酸中通入O2
B.b为亚硫酸中通入O2
C.c为氢硫酸中通入Cl2
D.d为亚硫酸中通入Cl2
14.用15mL2mol· L-1的H2SO4溶液与15mL3 mol· L-1的Na2CO3溶液反应来制取二氧化碳,欲制得最多的二氧化碳,则下列叙述正确的是[ ]
A.把两种溶液快速混合并不断搅拌
B.把两种溶液缓慢混合并不断搅拌
C.把Na2CO3溶液滴加到H2SO4溶液中
D.把H2SO4溶液滴加到Na2CO3溶液中
15.下列各组溶液,不用其它试剂,不比较温度变化,就可以将它们区分开的是[ ]
A.盐酸、氢氧化钠、硝酸钠、硫酸钠
B.盐酸、硝酸银、氢氧化钠、硝酸钠
C.氢氧化钠、硫酸镁、碳酸钠、硫酸氢钠
D.氯化钡、硫酸钠、氯化钙、硝酸钙
16.常温用水稀释0.1mol· L-1的醋酸钠溶液,溶液中增大的是 [ ]
17.把一定量的有机物溶于NaOH溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液颜色变浅,再加入盐酸,显酸性析出白色晶体,取少量晶体放到FeCl3溶液中,溶液呈紫色,则有机物可能是下列物质中的 [ ]
三、选择题(每小题只有1个正确答案,每小题4分,共32分)
18.一定温度下,向质量分数为a的乙腈(CH3CN)溶液中加入等体积的水,所得溶液中乙腈的质量分数为0.4a,若乙腈的密度为ρ1,水的密度为ρ2,则下列说法正确的是
(A)ρl>ρ2 (B)ρl<ρ2 (C)ρl=ρ2 (D)无法确定
19.ag锌粉、铝粉和镁粉的混合物,与质量分数为25%的稀硫酸恰好完全反应,蒸发水分后,得固体C(不含结晶水)bg,则反应生成氢气的质量为[ ]
![]()
20.在25℃时,纯水的电离度为α1;pH=11的氨水中水的电离度为α2;pH=3的盐酸中水的电离度为α3;若将上述氨水与盐酸等体积混合,所得溶液中水的电离度为α4。则下列关系正确的是[ ]
(A)αl<α3<α2< α4 (B)α3<α2<α1<α4
(C)α2=α3<α1<α4 (D)α2=α3<α4<α1
![]() 21.一定条件下,在一密闭容器中通入一定量SO2和O2的混合气,发生如下反应:
21.一定条件下,在一密闭容器中通入一定量SO2和O2的混合气,发生如下反应:
反应达平衡后SO2、O2和SO3的物质的量之比为3∶4∶6,保持其他条件不变,降低温度后达到新的平衡时,O2和SO3的物质的量分别是1.1mol和2.0 mol,此时容器内SO2的物质的量应是[ ]
(A)0.7 mol(D)0.9 mol(C)1.1mol(D)1.3 mol
22.在20℃时,将一种可溶性盐与一种不溶物组成的固体混合物30g投入40g水中,充分搅拌溶解、过滤,尚余固体15.6g。此15.6 g固体再加入40 g水中充分搅拌溶解、过滤,还剩下5 g,则该可溶性盐在20℃时的溶解度为
(A)26.5 g (B)31.25 g (C)36.0 g (D)无法计算
23.将一定量的钠铝合金置于水中,合金溶解,得到20mL、pH=14的溶液。然后用1mol·L-1的盐酸滴定至沉淀量最大时,消耗盐酸40mL。原合金中钠的质量为[ ]
A.0.92g B.0.69g C.0.46g D.0.23g
![]()
![]()
![]()
A.大于m% B.等于m%
C.小于m% D.无法判断
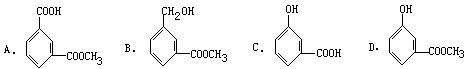
25.对于任何一个化学反应过程,不论该化学反应过程是一步完成,还是多步完成,其反应放出或吸收的总热量始终相同。已知,在相同条件下2mol碳燃烧生成2mol CO放出的热量为Q1;1mol碳燃烧生成1molCO2放出的热量为Q2,则Q1与Q2的关系是[ ]
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.无法判断
第Ⅱ卷(选择题共67分)
四、实验题(共2小题,14分)
26、(4分)下列操作或发生事故时的处理方法正确的是___ _(填字母)
(每选对1个给1分,全选对者加1分,多选不限,但每选错一个倒扣1分)
A.将pH试纸用蒸馏水湿润后,测定稀盐酸的pH值
B.称量一定质量NaOH固体时,应将NaOH放在小烧杯中称量
C.配制一定浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度。
D.浓H2SO4不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂抹小苏打溶液
E.使用酒精灯时不慎倾倒在桌面上而失火,应立即用湿抹布盖灭
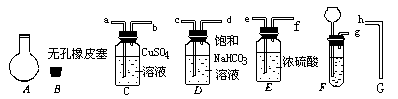 27.(10分)实验室可以用下图所示仪器连接起来制备纯净的二氧化碳并测定其式量。
27.(10分)实验室可以用下图所示仪器连接起来制备纯净的二氧化碳并测定其式量。
现用含有少量硫化亚铁的大理石和盐酸反应制备二氧化碳气体,实验步骤如下:(1)将橡皮塞B塞在A烧瓶口,并用橡皮筋套在烧瓶的瓶颈处以标记橡皮塞所塞入瓶颈的深度,准确称其质量为m1g。
(2)连接制备和净化气体的装置,其连接顺序是:_ _接_ _,_ _接_ _,_ _接__ ,_ _接__ 。
(3)将导管G插入烧瓶A中用向___ _(填“上”或“下” )排空气法收集二氧化碳气体;检验二氧化碳气体已经充满烧瓶的方法是___ __ _。
若经检验,二氧化碳气体已经充满烧瓶,迅速用橡皮塞塞好烧瓶瓶口,并称其质量为m2g。
(4)将烧瓶口橡皮塞取下,向烧瓶内注水至标记线,再将水小心地倒入量筒测量出水的体积为V1 mL;将该体积换算成标准状况时的体积为V2mL。请写出二氧化碳式量的计算式__ _____。
若不将气体净化和干燥,所测定的二氧化碳式量的数值将会_____(填“偏高”或“偏低” ),其理由是:___
五、(本题包括4小题,共22分)
28、(3分)有文献报道,硫在空气中燃烧时,产物中的SO3约占5%—6%(体积),而硫在纯氧中燃烧时,其产物中的SO3约占2%—3%(体积),解释这一现象的正确的理由是:
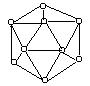 29、(4分)已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),其中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算得出此基本单元是由 个硼原子构成。其中B—B键的键角为
。
29、(4分)已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),其中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算得出此基本单元是由 个硼原子构成。其中B—B键的键角为
。
30.(6分)已知25℃时0.1mol·L-1醋酸溶液的pH约为3。向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了[OH-],因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH增大。
你认为上述两种解释中___ __(“甲”或“乙” )正确。
(1) 为了验证上述哪种解释正确,继续做如下实验:向0.1mol·L-1的醋酸溶液中加入少量下列物质_____。(填写编号),然后测定溶液的pH。
(A)固体CH3COOK (B)固体CH3COONH4
(C)气体NH3 (D)固体NaHCO3
(2)若____(填“甲”或“乙” )的解释正确,溶液的pH应____(填“增大”、“减小”或“不变” )。
(已知:25℃时,0.1mol·L-1氨水的电离度为1.3%,0.1mol·L-1醋酸的电离度为1.3%)
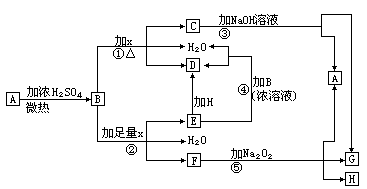 31.(9分)物质A—H有下图所示转化关系(部分反应物、生成物没有列出)。其中,B的浓溶液与单质X在加热时才能发生反应①,B的稀溶液与足量X发生反应②,向C溶液中滴入KSCN溶液呈红色。
31.(9分)物质A—H有下图所示转化关系(部分反应物、生成物没有列出)。其中,B的浓溶液与单质X在加热时才能发生反应①,B的稀溶液与足量X发生反应②,向C溶液中滴入KSCN溶液呈红色。
试填写下列空白:
(1) 晶体A是(化学式)________________________。
(2)反应②的离子方程式:______________________。
(3)根据图示信息判断,足量B的浓溶液与单质X共热时能否产生E,说明理由(写出化学方程式回答):____________________。
(4)在反应⑤中,若生成物G与H的物质的量之比为4∶1,写出F溶液与Na2O2反应的化学方程式:_______________________。
六、(本题包括2小题,共17分)
32、(8分)某α—氨基酸,分子量不超过200,经分析可知,该氨基酸含C、H、O、N四种元素,其中氮元素的质量分数为8.5%,氧的质量分数为19.4%。
(1)该氨基酸的分子中有 个—NH2, 个—COOH。
(2)该氨基酸分子量(取整数值)为 。
![]() (3)若氨基酸分子结构中无甲基(—CH3),有和苯环,写出其结构简式
。
(3)若氨基酸分子结构中无甲基(—CH3),有和苯环,写出其结构简式
。
(4)另有一种有机物A是上述氨基酸的同分异构体,A分子中也含有苯环,但不含—NH2和—COOH,且苯环上的一卤代物只有一种,则A的结构简式可能
为: 、 。
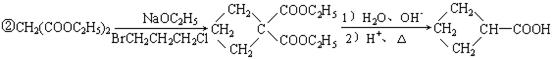
![]() 33、(9分)已知:①乙醛甲基上的氢原子是α氢原子,活性较大,可以与甲醛中的醛基发生加成反应,如:
33、(9分)已知:①乙醛甲基上的氢原子是α氢原子,活性较大,可以与甲醛中的醛基发生加成反应,如:
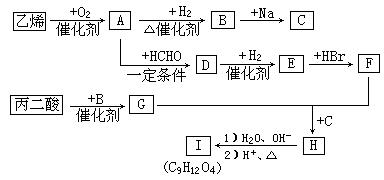
现由乙烯和丙二酸等物质合成I,合成路线如下:
请回答下列问题:
(1)写出下列物质的结构简式:
E 、H
I ;
(2)写出A→D的化学方程式:(有机物写结构简式):
。
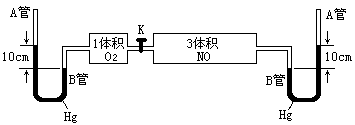 34、(6分)如图所示,打开两个容器间的活塞K,使两种气体混合,充分反应,达到平衡状态时(温度不变),A管中汞液面比B管中汞液面高7.1cm,(反应开始时高10cm),设此温度
34、(6分)如图所示,打开两个容器间的活塞K,使两种气体混合,充分反应,达到平衡状态时(温度不变),A管中汞液面比B管中汞液面高7.1cm,(反应开始时高10cm),设此温度
产物为气态,汞蒸汽压忽
略不记,体系容积为定值。
求NO2转化为N2O4的转
化率。
35.(8分)向100 mL某二价金属M的氢氧化物澄清溶液中加入过量的 NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的盐酸溶液中,在标准状况下收集到4.48L气体。将滤液加水稀释至 250 mL,取出 25 mL恰好与 20 mL盐酸完全反应,在标准状况下收集到1.12L气体。
(1)M的氢氧化物澄清溶液与NaHCO3溶液反应的化学方程式为:
___ __。
(2)要计算金属M的原子量,你认为还必须提供下列哪项数据(填写供选项字母序号)____。
(A)M的氢氧化物溶液的物质的量浓度(设为2mol·L-1)
(B)M的碳酸盐的质量(设为39.4 g)
(C)与M的碳酸盐反应的盐酸的物质的量浓度(设为 0.1mol·L-1)
(D)题设条件充足,不需要补充数据。
(3)根据你的选择,试计算金属M的原子量和加入的NaHCO3溶液中所含的NaHCO3的质量。
1999—2000学年度第二学期期末高二化学试卷
答案及评分标准
选择题(1—5题3分,6—17题答对3分,少选1分,错选0分,18—25题4分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | B | D | C | C | B | B | D | B | BD | A | AD | AD |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | C | BC | AD | D | B | C | D | A | C | A | A | B |
四、实验题(共14分)
26、(4分)B、D、E(每选对1个给1分,全选对加1分,多选不能加分,且每多选1个倒扣1分)
27、(10分)
(1)g接a,b接c,d接e,f接h。或g接c,d接a,b接e,f接h。(2分)
(3)上;用燃着的木条放在瓶口,若火焰熄灭,则证明CO2已经充满。(3分)
偏低:因为含有H2S、HCl、H2O等杂质气体的式量均小于CO2的式量。
五、(共22分) (3分)
28、(3分)
在纯氧中燃烧时,因氧气浓度大,反应速率快(1分),单位时间放出热量多,使温度升高(1分),而SO2氧化成SO3的反应是放热反应,平衡向SO3分解的方向移动,使SO3的含量降低,此时温度的影响大于浓度的影响。(1分)
29、(4分) 12、 60º (各2分)
30、(6分)
乙;(2分) (1)B;(2分) (2)乙,(1分) 增大。(1分)
31、(9分)
(1)NaNO3 (1分)
(2)3Fe+2NO3+8H+![]() 3Fe2++2NO↑+4H2O
(2分)
3Fe2++2NO↑+4H2O
(2分)
(或:Fe+NO3-+4H+![]() Fe3++NO↑+2H2O
Fe3++NO↑+2H2O
2Fe3++Fe![]() 3Fe2+)
3Fe2+)
(3)由反应④:NO+2HNO3(浓)![]() 3NO2+H2O (2分)
3NO2+H2O (2分)
可知在浓HNO3中不能生成NO (1分)
(4)4Fe(NO3)2+4Na2O2+6H2O![]() 4Fe(OH)3↓+O2↑+8NaNO3 (3分)
4Fe(OH)3↓+O2↑+8NaNO3 (3分)
六、(共17分)
32、(8分) (1)1; 1 (各1分) (2)165 (1分)
![]() (3)
(3)
(1分)
(4) 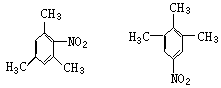
(各2分)
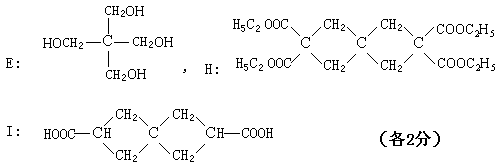 33、(9分)
33、(9分)
(1)
(2)CH3CHO+3HCHO→C(CH2OH)3CHO (3分)
七、(共14分)
34、(8分)解:设反应前NO为3mol,O2为1mol,反应前气体总物质的量为4mol。
混合后发生反应: 2NO + O2 == 2NO2
2mol 1mol 2mol (1分)
剩余NO为1mol,设有物质的量为x的NO2转化为N2O4。
2NO2==N2O4
平衡时:2mol-x x/2 (1分)
平衡时气体总物质的量==1mol+2mol-x/2==3mol-x/2 (1分)
在恒温、恒容下,气体的压强比等于物质的量的比:
![]()
解得:x==0.32mol (2分)
所以,NO2的转化率为:0.32mol/2mol×100%==16% (1分)
35、(8分)(1)M(OH)2+2NaHCO3=MCO3↓+2H2O+Na2CO3(1分)
(2)B (3分)多选不得分
(3)解: MCO3~CO2
1mol 22.4 L
x 4.48 L
x=0.20 mol
![]()
M的原子量=197-60=137………………………………………(2分)