2003-2004学年度上学期
高中学生学科素质训练
高二化学同步测试(9)—盐类水解
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
1.在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是
( )
A.氯化铝 B.碳酸氢钠 C.硫酸镁 D.高锰酸钾
2.在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓
度分别为Amol·L-1与Bmol·L-1,则A和B的关系为 ( )
A.A>B B.A=10-4B C.B=10-4A D.A=B
3.在FeCl3和Fe2(SO4)3的混合溶液中,若不计Fe3+的水解,当溶液中c(Fe3+)=
c(SO![]() )
)
时,下列判断正确的是 ( )
A.c(Fe3+)>c(Cl-)
B.c(SO![]() )>c(Cl-)
)>c(Cl-)
C.c(SO![]() )<c(Cl-)
D.FeCl3和Fe2(SO4)3的物质的量相等
)<c(Cl-)
D.FeCl3和Fe2(SO4)3的物质的量相等
4.下列离子,在水溶液中不发生水解的是 ( )
A.Ag+ B.I- C.F- D.Cu2+
5.在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是 ( )
A.c(Na+)﹥c(CH3COO-)﹥c(OH-)﹥c(H+) B.c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
C.c(Na+)﹥c(CH3COO-)﹥c(H+)﹥c(OH-) D.c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
6.向含下列离子的溶液中分别加入NaOH固体(溶液体积不变),能引起离子浓度减小的是 ( )
A.Cl- B.OH- C.AlO2- D.HCO3-
7.在0.1 mol·L-1 Na2CO3溶液中欲使CO32-的浓度尽量接近0.1 mol·L-1,则应向溶
液中加 ( )
A.HCl B.NaOH C.NaCl D.H2CO3
8、0.1 mol·L-1盐酸分别跟20 mL NaOH和20 mL NH3·H2O反应,都消耗了20 mL
盐酸,这表明NaOH溶液和氨水的关系 ( )
A.物质的量浓度相同 B.氢氧根离子浓度相同
C.pH相同 D.溶液中离子浓度相同
9.在一定条件下发生下列反应,其中属于盐类水解反应的是 ( )
A.NH4+ +2H2O ![]() NH3·H2O + H3O+
NH3·H2O + H3O+
B.HCO3- + H2O
![]() H3O+ + CO32-
H3O+ + CO32-
C.HS-+H+=== H2S
D.Cl2+H2O ![]() H++Cl-+HClO
H++Cl-+HClO
10.常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得的溶液pH ( )
A.等于7 B.大于7 C.小于7 D.无法确定
二、选择题(本题包括16小题,每小题3分,共48分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
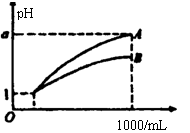 11.pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是 ( )
11.pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是 ( )
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
12.室温下0.1mol·L-1HCl溶液滴定a mL某浓度的NaOH溶液,达
终点时消耗HCl溶液b mL,此时溶液中氢氧根离子的浓度[OH-]
(mol·L-1)是 ( )
A.1×10-7 B.1×107 C.0.1b/(a+b) D.0.1a/(a+b)
13.在25℃时,向VmL pH=10的KOH溶液中,加入pH=b的NaOH溶液10V mL,所得混合溶液中c(Cl-)=c(Na+),则此时(a+b)为 ( )
A.15 B.14 C.13 D.不能确定
14.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶
液中有关微粒的浓度关系正确的是 ( )
A.c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C.c (Ac-)=c (Cl+)>c (H+)>c (HAc)
D.c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-)
15.下列各组数据关系中,前者比后者大的是 ( )
A.纯水100℃和25℃时的pH
B.Na2CO3溶液中的HCO3-和OH-数目
C.常温下,pH=1的KOH溶液和pH=11的CH3COOK溶液中由水电离出的OH-离子浓度
D.100mL0.1mol·L-1的CH3COOH溶液与10mL0.1mol·L-1的CH3COOH溶液的H+数目
16.用物质的量是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中
c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是 ( )
A.c(H+)>c(OH-) B.c(CH3COO-)+c(CH3COOH)=0.2 mol·L-1
C.c(CH3COOH)>c(CH3COO-) D.c(CH3COO-)+c(OH-)=0.1 mol·L-1
17.为了同时对某农作物施用分别含有N、P、K三种元素的化肥,对于给定的化肥.
①K2CO3 ②KCl ③Ca(H2PO4)2 ④(NH4)2SO4 ⑤氨水,最适合的组合是
A.①③④ B.②③④ C.①③⑤ D.②③⑤
18.某溶液中FeCl3的水解反应已达平衡.FeCl3+3H2O ![]() Fe(OH)3+3HCl若要使
Fe(OH)3+3HCl若要使
FeCl3的水解程度增大,应采取的方法是 ( )
A.加入NaHCO3 B.加入AgNO3 C.加FeCl3固体 D.加热
19.下列各组溶液混合后,溶液显碱性的是 ( )
A.10 mL 0.1 mol·L-1 NH3·H2O与10mL0.1mol·L-1HCl
B.0.1 mol·L-1 K2S10mL与0.1mol·L-1K2SO410mL
C.0.1 mol·L-1 KOH 10mL与0.1 mol·L-1 KHCO310mL,再加入
0.1mol·L-1BaCl210mL
D.0.1 mol·L-1NaOH10mL与0.1mol·L-1H2SO45mL
20.某溶液中由水电离产生的c(H+)等于10-10 mol·L-1,该溶液的溶质不可能的是( )
A.Ca(OH)2 B.HCl C.NaHCO3 D.Fe(NO3)3
21.一种一元强酸HA溶液中加入一种碱MOH反应后,溶液呈中性,下列判断正确的
是 ( )
A.加入的碱过量 B.混合前酸与碱中溶质的物质的量相等
C.生成的盐不发生水解 D.反应后溶液中A-、M+物质的量浓度相等
22.CH3COOH与CH3COONa等物质的量混合配制成的稀溶液,pH为4.7。下列说法错
误的是
A.CH3COOH的电离作用大于CH3COONa的水解作用
B.CH3COONa的水解作用大于CH3COOH的电离作用
C.CH3COOH的存在抑制了CH3COONa的水解
D.CH3COONa的存在抑制了CH3COOH的电离
23.下列反应的离子方程式正确的是 ( )
A.硫酸铝溶液和小苏打溶液反应 Al3++3HCO3-==3CO2↑+Al(OH)3↓
B.向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+ SO2+ H2O == CaSO3¯+2HClO
C.硫化亚铁中加入盐酸 S2-+2H+==H2S↑
D.钠和冷水反应 Na+2H2O==Na++H2↑+2OH-
24.有一种酸式盐AHB,它的水溶液显弱碱性,今有下列说法,其中正确的是 ( )
A.同浓度的AOH溶液和H2B溶液,电离程度前者大于后者
B.HB-的电离程度大于HB-的水解程度
C.该盐的电离方程式为AHB === A++HB-
D.在溶液中离子浓度大小顺序一般为.c(A+)>c(HB-)>c(OH-)>c(B2-)>c(H+)
25.下列说法正确的是 ( )
A.水解反应是吸热反应 B.升高温度可以抑制盐类的水解
C.正盐水溶液pH均为7 D.硫酸钠水溶液pH小于7
26.某元素X的相对原子质量为a,它的最高氧化物的水化物的分子式为HmXOn(m>1)。
下列有关叙述中一定正确的是 ( )
A.该酸的水溶液中,c(H+)∶c(XO![]() )=n∶1
)=n∶1
B.该酸的摩尔质量为(m+a+16n)g
C.100 mL该酸溶液,能中和4g NaOH
D.若0.1molL-1该酸溶液的pH=1,则NamXOn的水溶液的pH>7
三、填空题
27.(6分)在1 mol·L-1 Na2CO3溶液中,欲使CO32-的浓度尽量接近1mol·L-1,则应向
溶液中加入少量的_______________________或______________________________
原因是 。
28.(3分)将0.2 mol·L-1的CH3COONa溶液与0.1mol·L-1 HCl等体积混合后,溶液
中各种离子的浓度按其从大到小的顺序应为 。
29.(4分)配制氯化铁溶液常出现浑浊现象,其原因是___________________________。
如何操作既可得到透明溶液而又不引进杂质离子____________________________
_______________________________________
30.(11分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是.
![]() ①
①
NH4++H2O===NH3·H2O+H+……②
H++OH-===H2O……③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是.
Mg(OH)2(固)====Mg2++2OH-……①
NH4++OH-===NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是___________(填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由_________________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式_________________。
四、计算题(8分)
31.氢氧化镁难溶于水,但它所溶解的部分全部电离。t℃时,饱和Mg(OH)2溶液的pH=11,
若不考虑KW的变化,则该温度下Mg(OH)2的溶解度为?
(溶液的密度为1.0 g·cm-3)
参考答案
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | D | B | A | D | B | A | A | B |
二、选择题(本题包括16小题,每小题3分,共48分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | A | C | BD | D | AB | B | AD | B | CD |
| 21 | 22 | 23 | 24 | 25 | 26 | ||||
| D | B | A | AD | A | D |
三、填空题
27、NaOH;NaHCO3;它们都能起到抑制CO32-水解的作用
28、Na+、CH3COO-、Cl-、H+、OH-
29、Fe3+易发生水解反应生成Fe(OH)3,导致配制FeCl3溶液出现浑浊;
在配制FeCl3溶液时先加入少量盐酸,再加水稀释,便可抑制FeCl3的水解,得到透
明溶液,又没有引进杂质离子
30、(1)B
(2)CH3COONH4溶液呈中性,滴入Mg(OH)2 悬浊液,若Mg(OH)2不溶解,则说明乙同学解释正确,若Mg(OH)2不溶,则甲同学解释正确。
(3)乙;Mg(OH)2+2NH4+=Mg2++2NH3·H2O
31、0.0029g