第一节 第二课时
1、能说明醋酸是弱电解质的事实是 ( )
A.醋酸溶液的导电性比盐酸弱
B.醋酸溶液与碳酸钙反应,缓慢放出二氧化碳
C.醋酸溶液用水稀释后,氢离子浓度下降
D.0.1mol/L的CH3COOH溶液中,氢离子浓度约为0.001mol/L
2、下列叙述中,能证明某物质是弱电解质的是 ( )
A.溶化时不导电
B.水溶液的导电能力很差
C.不是离子化物,而是极性共价化合物
![]() D.溶液中已电离的离子和未电离的分子共存
D.溶液中已电离的离子和未电离的分子共存
3、 在CH3COOH CH3COO— + H+的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是 ( )
![]() A.加入NaOH B.加入盐酸 C.加水 D.升高温度
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
![]() 4、在二氧化碳的水溶液中存在如下平衡体系:H2CO3
H+ +HCO3— 和 HCO3—
H+ +CO32—,PH值增大时,CO32—的浓度将 ( )
4、在二氧化碳的水溶液中存在如下平衡体系:H2CO3
H+ +HCO3— 和 HCO3—
H+ +CO32—,PH值增大时,CO32—的浓度将 ( )
A.增大 B.减小 C.不变 D.可能增大,也可能减小
5、一定量的盐酸跟足量的铁粉反应时,为了减缓化学反应速率,且不影响生成的H2的总量,可向盐酸中加入适量的 ( )
A.NaOH B.CH3COOH C.H2O D.CH3COONa固体
6、在等浓度的两种一元弱酸钠盐溶液中分别通入适量CO2,发生如下反应:
NaR+CO2+H2O→HR+NaHCO3, NaR,+CO2+H2O→HR,+Na2CO3。则两弱酸酸性强弱比较正确的是 ( )
A. HR较强 B. HR,较强 C. 两者差别不大 D.无法比较
7、将C(H+)=1×10—2mol/L的CH3COOH和HCl溶液分别稀释100倍,稀释后两溶液的C(H+)的物质的量浓度分别为a和b,则a和b的关系为 ( )
A.a>b B.a<b C.a=b D.不能肯定
8、同浓度同体积的氢硫酸与盐酸相比,下列既能表明氢硫酸是弱酸,又能表明盐酸是强酸的是 ( )
A. C(H+) :盐酸大于氢硫酸
B. 中和能力:氢硫酸是盐酸的2倍
C.盐酸中:C(H+) =C(Cl-),氢硫酸中:C(H+)/(S2-)>2
D.各稀释一倍:盐酸中C(H+) 减半,而氢硫酸中C(H+)未减半
9、用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
( )
A.C(OH—)/C(NH3·H2O) B.C(NH3·H2O)/ C(OH—)
C.C(OH—) D.n(NH4+)
10.下列事实能证明氯化氢是共价化合物的是 ( )
A.氯化氢极易溶于水 B.液态氯化氢不导电
C.氯化氢不易分解 D.氯化氢溶液可以电离
11、向Na2CO3的浓溶液中加入稀盐酸,直到不再生成二氧化碳为止,则在止过程中,溶液中的碳酸氢根离子浓度变化趋势可能是 ,
A.逐渐减小 B.先逐渐增大,后逐渐减小
C.逐渐增大 D.先逐渐减小,后逐渐增大。
试用化学方程式和必要的文字表述其理由
12、在a、b两支试管中,分别加入形态相同,质量相等的一颗锌粒,然后向两支试管中,分别加入相同物质的量、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中的现象,相同点是 ;不同点是 ;原因是 。
 (2)当锌过量时,a、b两支试管中生成气体的体积,开始时a 于b,反应完毕后生成气体的总体积是a 于b,原因是
。
(2)当锌过量时,a、b两支试管中生成气体的体积,开始时a 于b,反应完毕后生成气体的总体积是a 于b,原因是
。
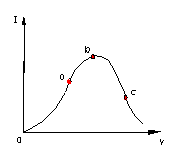
13、在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的由线如右图所示。请回答:
⑴“O”点导电能力为O的理由是
⑵a,b,c三点溶液中C(H+)由小到大的顺序为
⑶a,b,c三点中电离度最大的是
若使C点溶液中[Ae-]增大,溶液[H+]减小,可采取的措施是:
① ② ③