福州市2005-2006学年第一学期高三期末质量检查
化学试卷
(完卷时间:120分钟;满分:100分)
可能用到的相对原子质量:H-1、C-12、N-14、O-16、Na-23、Mg-24、Al-27、P-31、S-32、Fe-56、Cu-64
(Ⅰ卷 共50分)
一、选择题:(下列各题只有一个选项符合题意。每小题2分,共50分)
1.2005年10月12日,中国“神舟六号”载人飞船顺利升空,5天后又安全着落。在升空和着落时,为了防止飞船与大气层摩擦产生高温而燃烧,应该选择某种特殊材料覆盖在飞船表面,这种材料应该具有的性质是
A.良好的导电性
B.密度较大,以增大飞船的惯性
C.高温下能分解挥发,吸收热量
D.质地柔软,以利于飞船的变形
2.航天飞船可用肼(N2H4)和过氧化氢为动力源。已知1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量。下列说法错误的是
A.该反应中肼作还原剂
B.液态肼的燃烧热为20.05kJ/mol
C.该动力源的突出优点之一是反应产物对环境无污染
D.肼和过氧化氢中的化学键类型及它们的晶体所属类型均相同
3.设NA为阿伏加德罗常数,下列说法正确的
A.1mol甲基正离子(CH3+)所含电子数为10NA
B.标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为NA
C.500mL 0.5mol/L的Ca(ClO)2溶液中,含有ClO-的数目为0.5 NA
D.31g白磷分子中有NA个P-P键
4.相同温度下物质的量浓度相等的下列溶液中,pH最小的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
5.常温下某溶液中由水电离的c(H+)=10—10mol·L—1,该溶液中溶质不可能是
A.NaHSO4 B.Al2(SO4)3 C.NaOH D.HCl
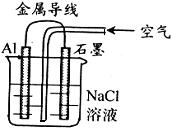 6.关于右图装置的叙述,正确的是
6.关于右图装置的叙述,正确的是
A.铝是负极,铝片上析出无色气体。
B.石墨是阳极,石墨棒上析出黄绿色气体
C.溶液中两电极间产生白色沉淀。
D.溶液中先产生白色沉淀,最后沉淀溶解。
7.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法正确的是
A.羰基硫的属于非极性分子
B.羰基硫沸点比CO2低
C.羰基硫的电子式为:
D.羰基硫分子中三个原子处于同一直线上
 8.下列装置中间的试管收集浓硝酸和铜反应所生成的气体,最终可使收到的气体中空气的含量最少是
8.下列装置中间的试管收集浓硝酸和铜反应所生成的气体,最终可使收到的气体中空气的含量最少是
9.下列几组顺序排列不正确的是
A.沸点高低:HI>HBr>HCl>HF B.热稳定性大小:HF>H2O>NH3 >PH3
C.熔点高低:石墨>金刚石>食盐>金属钠>冰 D.微粒半径大小:S2->Cl->F->Na+>Al3+
10.下列各组离子,在所给的条件下能够大量共存的是
A.在pH = 0的溶液中:Fe2+、Mg2+、SO42-、NO3-
B.由水电离出的c(H+) = 1×10-12 mol/L的溶液中:HCO3-、K+、Na+、S2-
C.在AlCl3溶液中:SO32-、Na+、CO32-、AlO2-
D.在滴加酚酞试液后呈红色的溶液中:I-、AlO2-、Na+、S2-
11.在下列几种物质中 ①NaHCO3、②Al(OH)3、③(NH4)2CO3、④H2N-CH2COOH、⑤金属铝、⑥Al2O3、⑦单质硅、⑧SiO2 其中跟HCl溶液和NaOH溶液都能发生反应的是
A.只有②④⑥ B.只有①⑤⑥ C.只有①②③④⑤⑥ D.全部都可以
12.某有机物的结构简式是![]() ,该物质不应有的化学性质是
,该物质不应有的化学性质是
①可以燃烧、②可以跟溴加成、③可以将KMnO4酸性溶液还原、④可以跟NaHCO3溶液反应、⑤可以跟NaOH溶液反应、⑥可以发生消去反应
A.①③ B.③⑥ C.④⑥ D.④⑤
13.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) ![]() zC(g)(正反应为放热反应);达到平衡后测得A气体的浓度为0.5mol·L-1;当恒温下将密闭容器的容积扩大一倍并再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
zC(g)(正反应为放热反应);达到平衡后测得A气体的浓度为0.5mol·L-1;当恒温下将密闭容器的容积扩大一倍并再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
A.平衡向右移动 B.x+y>z C.B的转化率提高 D.C的体积分数增加
14.以下实验操作将导致所测结果数据偏高的是
A.用量筒量一定溶液的体积,读数时俯视液面
B.用托盘天平测量一定固体的质量,读数时托盘左低右高
C.中和滴定测量未知酸溶液的浓度,锥形瓶未用待装的酸溶液润洗
D.做硫酸铜晶体含水量测定实验,加热后的坩埚冷却过程未放入干燥器
15.将SO2通入BaCl2溶液至饱和未见沉淀生成,继续通入某种气体仍无沉淀生成,则该气体可能是
A.CO2 B.NH3 C.Cl2 D.H2S
16.已知(l)![]() =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·![]()
(2)![]() =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·![]()
(3)![]() =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·![]()
(4)![]() =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·![]()
下列关系式中正确的是
A.a<c <0 B.2a=b<0 C.b>d>0 D.2c=d>0
17.下列叙述中正确的是
A.在元素周期表中,零族元素的单质在常温下全部都是气体
B.同周期元素,ⅦA族的原子半径最大
C.ⅥA族元素的原子,其半径越大,越容易得到电子
D.所有主族元素的原子形成单原子离子时的最高化合价数都和它的族序数相等
![]() 18.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)下列说法正确的是
18.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)下列说法正确的是
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
19.已知某溶液中存在![]() 、
、![]() 、
、![]() 和
和![]() 四种离子,其浓度大小有如下关系,其中可能的是
四种离子,其浓度大小有如下关系,其中可能的是
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(H+)>c(NH4+)>c(OH-)
③c(H+)>c(OH-)> c(NH4+) > c(Cl-) ④c(OH-)>c(H+)>c(Cl-)>c(NH4+)
⑤c(Cl-)=c(NH4+)且c(H+)=c(OH-)
A.①②③⑤ B.①②⑤ C.①④ D.④⑤
20.对于相同体积的K2CO3溶液(浓度为c1)和(NH4)2CO3溶液(浓度为c2),若其中CO32-的物质的量浓度相同,则c1和c2的关系是
A.c1=2c2 B.c1>c2 C.c1=c2 D.c1<c2
 21.按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体可能是
21.按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体可能是
A.H2 B.CO和H2 C.NH3 D.CH3CH2OH(g)
22.足量的浓H2SO4与 m g铜完全反应,得到的SO2气体的体积为 n L(20℃,1.01×105Pa),则被还原的硫酸是
A.m/64 mol B.64n/22.4 mol C.98n/22.4g D.64n/22.4g
23.用已知浓度为98%的密度为1.84g/mL的浓硫酸,来配制质量分数为49%的硫酸溶液,试确定取用的98%的浓硫酸与水的体积比
A.小于1 B.等于1 C.大于1 D无法确定
24.有机物A和B只由C、H、O三元素中2种或3种组成,相等物质的量的A和B分别燃烧时,消耗相等物质的量的氧气。则A和B的相对分子质量的差值不可能是(n为小于5的正整数)
A.44n B.18n C.14n D.0
 25.把一定量的有机物溶于NaOH的溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液颜色变浅,再加入盐酸,显酸性,析出白色晶体,取少量晶体放到FeCl3溶液中,溶液呈紫色,则有机物可能是下列物质中的
25.把一定量的有机物溶于NaOH的溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液颜色变浅,再加入盐酸,显酸性,析出白色晶体,取少量晶体放到FeCl3溶液中,溶液呈紫色,则有机物可能是下列物质中的
(Ⅱ卷 50分)
二.填空题(共18分)
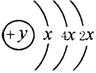 26(8分).A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A 的原子结构示意图如右图, B、C可形成离子化合物B3C2,据此填空:
26(8分).A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A 的原子结构示意图如右图, B、C可形成离子化合物B3C2,据此填空:
(1)A的元素名称为 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子半径由小到大的顺序为(用元素符号): 。
(3)B和C两最高价氧化物的水化物相互反应的离子方程式
。
(4) B3C2溶于足量水中发生反应的化学方程式: 。
 27.(8分)A、B、C、D、E、F、G、H、I九种物质存在如下的转化关系。其中A、D都是短周期元素单质。A所含的元素原子在短周期元素中半径最大(希有气体除外);E在常温常压下是气体,它可漂白品红溶液。
27.(8分)A、B、C、D、E、F、G、H、I九种物质存在如下的转化关系。其中A、D都是短周期元素单质。A所含的元素原子在短周期元素中半径最大(希有气体除外);E在常温常压下是气体,它可漂白品红溶液。
(1)请依次写出A、B的化学式: 、 。
(2)请依次写出G、C的电子式: 、 。
(3)请写出以下变化的化学方程式:
D→E ;
C + F 。
三、有机填空题(12分)
28(12分).已知溴乙烷跟氰化钠反应后再水解可以得到丙酸:
|
|
![]()
![]() CH3CH2Br
CH3CH2CN CH3CH2COOH
CH3CH2Br
CH3CH2CN CH3CH2COOH
产物分子比原化合物分子多了一个碳原子,增长了碳链。请根据以下框图回答问题:
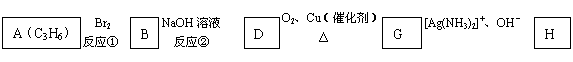 |
![]()
|
 | |||
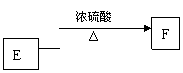 | |||
F分子中含有8个原子组成的环状结构。
(1)反应①②③中属于取代反应的是 。
(2)化合物E中含有的官能团的名称是 。
(3)G的结构简式为 。
(4)B生成D的化学方程式为:
。
(5)D与E反应生成F的化学方程式为:
。
四、实验题(6分)
29(6分).(1)将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲同学认为这是由于H2O2是二元酸(H2O2![]() H++HO2-),消耗了OH-,而使红色褪去。乙同学认为H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位同学的解释中谁正确。
H++HO2-),消耗了OH-,而使红色褪去。乙同学认为H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位同学的解释中谁正确。
(2)甲同学向品红溶液中通入一种气体后,品红褪色。乙同学设计了一个很简单的实验便知甲同学通的是Cl2还是SO2。他的实验方案是 。
五、计算题(14分)
30(14分).乙烯和乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45g水。试求:
(1)CO和CO2混合气体的物质的量=______________,生成的水的物质的量=______________。
(2)当a =1时,乙烯和乙烷的物质的量之比n(乙烯)∶n(乙烷)=______________。
(3)当a =1,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则b =____;
得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=______________。
(4)a的取值范围是_____________________;b的取值范围是______________________。
福州市2005-2006学年第一学期高三期末质量检查
化学试卷参考答案及评分标准
考试时间:120分钟。本卷满分:100分
(Ⅰ卷 共50分)
一、选择题:(下列各题只有一个选项符合题意。每小题2分,共50分)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | C | B | B | C | B | C | D | C | A | D | C | C |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| B | A | A | B | A | C | B | D | D | A | A | C | A |
(Ⅱ卷 50分)
二.填空题(共18分)
26(8分).(1)硅,SiH4 (各1分,共2分)
(2)N<P<Si<Mg (2分)
(3)Mg(OH)2 +2H+ Mg2++2H2O (2分)
(4)Mg3N2 + 8H2O= 3Mg(OH)2 +2NH3H2O(2分)
27(10分).(1)Na Na2O (各1分,共2分)
(2)![]()
![]() (各2分,共4分)
(各2分,共4分)
(3)S + O2 ![]() SO2 2Na2O2 + 2SO3
= 2Na2SO4 +O2(各2分,共4分)
SO2 2Na2O2 + 2SO3
= 2Na2SO4 +O2(各2分,共4分)
三、有机填空题(12分)
29(12分).(1)②③(2分) (2)羧基(2分) (3)CH3C—CHO (2分)
‖
O
(4)CH3CHBrCH2Br + 2 H2O →CH3CHOHCH2OH + 2HBr (3分)
|
‖
![]() (5)CH3—CH—CH2—COOH+HO—CH2
CH3—CH—CH2—C—O—CH2+2H2O
(5)CH3—CH—CH2—COOH+HO—CH2
CH3—CH—CH2—C—O—CH2+2H2O
![]()
![]() COOH
HO—CH—CH3
C O
CH—CH3
COOH
HO—CH—CH3
C O
CH—CH3
‖
O
(3分)
四、实验题(6分)
29(6分). (1)实验方案:向褪色后的混合溶液中加入NaOH溶液,若混合液变红,则甲同学正确;若混合液不变红,则乙同学正确。(3分)
(2)将溶液加热,如果溶液变红则说明通入的气体是SO2,不变红则说明通入的气体是Cl2。(3分)
四、计算题(14分)
30(14分).
(1)2a mol(2分), 2.5mol(2分) (2)1∶1(2分) (3)3(2分) 1∶3(2分)
(4)5/6<a<5/4(2分) 25/12<b<15/4(2分)