![]() 高三理综模拟考试
高三理综模拟考试
总分值:300分 考试时间:150分钟
一、在以下各题的四个选项中,只有一个选项是符合题目要求的。
1.吸附在呼吸道、消化道、皮肤上的抗体
A.构成人的第三道防线
B.可以产生特异性的体液免疫反应
C.能够使相应的细胞释放组织胺
D.能够使相应的细胞发生凝集
2.光照与光合效率的关系正确的是
A.光照越强,光合效率越高
B.阴生植物的光合效率与光照强度成反比
C.适宜的光照可以提高光合效率
D.当光照为0时,光合效率可以不为0
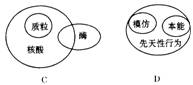 3.下列有关概念间相互关系的图示错误的是
3.下列有关概念间相互关系的图示错误的是
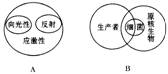
4.下列关于微生物代谢调节的说法中,错误的是
A.组成酶的合成只受遗传物质的控制
B.诱导酶产生后其活性不能一直保持下去
C.代谢产物将使直接催化形成此化合物的酶活性下降
D.细胞膜透性的改变可解除代谢产物对酶活性的抑制
5.下列关于基因和基因工程的叙述,正确的是
A.基因中的一条链作模板转录RNA,另一条链不转录RNA,称内含子
B.每条染色体都只含一个DNA分子,每个DNA分子上有若干个基因
C.同一生物体各体细胞核中含的基因种类相同,每个基因表达的机会均等
D.基因工程中一般不能直接从人体中分离基因导入细菌进一步表达产物
6.下列实验现象描述不正确的是
A.一瓶98%的硫酸敞口放置一段时间后,质量增加
B.将一瓶饱和的浓氨水打开瓶盖后会产生白雾
C.常温下一个不与任何物质反应的小球在水中悬浮,该小球放入CCl4中沉到底部
D.可用湿润的淀粉碘化钾试纸放在集气瓶口观察氯气是否集满
7.设NA表示阿伏加德罗常数,下列有关叙述正确的是
A.在标准状况下,22.4L臭氧中含有的氧原子个数为NA个
B. 1molOH-在电解过程中被氧化,提供电子的数目为NA个
C.1LPH=1的水溶液中,水合氢离子数为1NA
D. 常温常压下,1mol碳烯(:CH2)所含电子总数为8NA
8.几种短周期元素的原子半径及主要化合价如下表,下列叙述正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
A.M和T形成的化合物是两性化合物 B.Q的氢化物沸点高于T的氢化物沸点
C.L、M的单质与同浓度稀盐酸反应的速率是M>L D.L与Q形成的化合物属于共价化合物
9.下列离子方程式书写正确的是
A.向碳酸氢铵溶液中滴入过量氢氧化钠 HCO3-+OH-====CO32-+H2O
B.向碳酸氢钾溶液中滴入过量澄清石灰水
2HCO3-+Ca2++2OH-====CO32-+2H2O+CaCO3↓
C.次氯酸钠溶液中通入过量的二氧化硫 ClO-+SO2+H2O====HSO3-+HClO
D.亚硫酸氢钠溶液呈酸性 HSO3—+H2O![]() H3O++SO32—
H3O++SO32—
10.A、B为短周期元素,二者可以组合成多种中学生所熟知的化合物。在这些化合物中,A与B的原子个数比为A∶B=1∶2。已知A的原子序数为n,B的原子序数是:①n+2 ②n+3 ③n+4 ④n+5
⑤n+8 ⑥n-5 ⑦n-7 ⑧n-8中的几种,其中不符合题目要求的是
A.①④ B.②⑧ C.③⑤ D.⑥⑦
11.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
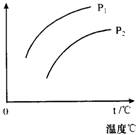 12.在容积一定的密闭容器中发生可逆反应A(g)+2B(g)
12.在容积一定的密闭容器中发生可逆反应A(g)+2B(g) ![]() C(g),△H>0;平衡移动关系如图所示.下列说法正确的是
C(g),△H>0;平衡移动关系如图所示.下列说法正确的是
A. P1>P2,纵坐标表示A的质量分数
B. P1>P2,纵坐标表示C的质量分数
C. P1<P2,纵坐标表示A的转化率
D. P1<P2,纵坐标表示混合气体的平均摩尔质量
13. “对氨基苯甲酸丁酯”是防晒霜的主要成分。下列关于“对氨基苯甲酸丁酯”的说法正确的是
A. 从有机物分类看,它可属于“氨基酸类”、“酯类”、“芳香烃类”
B. 它能与盐酸反应,但不能与苛性钠溶液反应
C. 甲酸丁酯基(![]() )有3种不同结构
)有3种不同结构
D. 它的分子式为![]()
二、在以下各题的四个选项中,有的只有一个选项是符合题目要求的,有的有多个选项符合题目的要求。
14.关于热现象,以下说法正确的是
A.所有自发的热现象都具有方向性
B.布朗运动的剧烈程度仅与温度有关
C.物体增加的内能一定是其他形式的能转化而来的
D.当物体温度升高时,物体内所有分子的运动速度都变大
15.在物理学发展史上有一些定律或规律的发现,首先是通过推理证明建立理论,然后再由实验加以验证,以下叙述内容,符合上述情况的有
A.牛顿发现的万有引力定律,经过一段时间后才由卡文迪许用实验方法测出万有引力恒量的数值,从而验证了万有引力定律
B.麦克斯韦提出电磁场理论并预言电磁波的存在,以后赫兹用实验证实了电磁波的存在
 C.汤姆逊提出了原子的核式结构学说,以后由卢瑟福用α粒子散射实验给予验证
C.汤姆逊提出了原子的核式结构学说,以后由卢瑟福用α粒子散射实验给予验证
D.爱因斯坦提出了光子说理论,以后由普朗克用实验证实了光子的存在
16.用图所示的方法可以测出一个人的反应时间,设直尺从开始自由下落,到直尺被受测者抓住,直尺下落的距离![]() ,受测者的反应时间为
,受测者的反应时间为![]() ,则下列说法正确的是
,则下列说法正确的是
A.![]() 与
与![]() 成正比 B.
成正比 B.![]() 与
与![]() 成正比 C.
成正比 C.![]() 与
与![]() 成正比
D.
成正比
D.![]() 与
与![]() 成正比
成正比
17.在同一地点有两个静止的声源,发出声波1和声波2在同一空间的空气中沿同一方向传播,如图所示为某时刻这两列波的图像,则下列说法中正确的是:
A.波1速度比波2速度大
B.相对于同一障碍物,波1比波2更容易发生衍射现象
C.这两列波传播的方向上,不会产生稳定的干涉现象
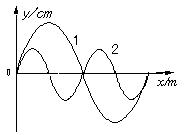 D.这两列波传播的方向上运动的观察者,听到的这两列波的频率均与从声源发出时的频率相同
D.这两列波传播的方向上运动的观察者,听到的这两列波的频率均与从声源发出时的频率相同
18.把一个带电小球a固定在光滑水平桌面上,在桌面的另一处放一个带电小球b.现给b一个沿垂直ab方向的水平速度![]() ,则下列说法正确的是
,则下列说法正确的是
A.若a、b为异性电荷,b球可能立即做匀速圆周运动
B.若a、b为异性电荷,b球可能做匀变速曲线运动
C.若a、b为同种电荷,b球一定做远离a的变加速曲线运动
D.若a、b为同种电荷,b球的动能一定会减小
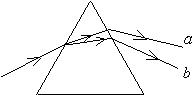 19.氢原子发出a、b两种频率的光,经三棱镜折射后的光路如图所示,若a光是由能级
19.氢原子发出a、b两种频率的光,经三棱镜折射后的光路如图所示,若a光是由能级![]() =4向
=4向![]() =2跃迁时发出时,则b光可能是
=2跃迁时发出时,则b光可能是
A.从能级![]() =5向
=5向![]() =2跃迁时发出的
=2跃迁时发出的
B.从能级![]() =4向
=4向![]() =3跃迁时发出的
=3跃迁时发出的
C.从能级![]() =5向
=5向![]() =4跃迁时发出的
=4跃迁时发出的
D.从能级![]() =3向
=3向![]() =2跃迁时发出的
=2跃迁时发出的
20.目前,载人宇宙飞船返回舱的回收常采用强制减速的方法,返回舱的整个运动过程可以简化为这样几个阶段:第一阶段,在返回舱进入大气层的过程中,返回舱在大气阻力和重力的共同作用下匀速下降.第二阶段,返回舱到了离地一定高度时打开降落伞使返回舱以较低的速度匀速落下.第三阶段,在返回舱接近地面时点燃反冲火箭使返回舱做匀减速运动直至落地.关于这三个阶段,下面说法中正确的是
A.第一阶段返回舱机械能随高度均匀减少
B.第二阶段返回舱的动量随高度均匀减少
C.第三阶段返回舱的动量随高度均匀减少
D.这三阶段中返回舱的动能都是随高度均匀地减少
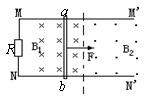 21.如图所示,水平放置的光滑金属长导轨
21.如图所示,水平放置的光滑金属长导轨![]() 和
和![]() 之间接有电阻
之间接有电阻![]() ,导轨左、右两区域分别处在方向相反与轨道垂直的匀强磁场中,方向见图,设左、右区域磁场的磁感强度为
,导轨左、右两区域分别处在方向相反与轨道垂直的匀强磁场中,方向见图,设左、右区域磁场的磁感强度为![]() 和
和![]() ,虚线为两区域的分界线.一根金属棒ab放在导轨上并与其正交,棒和导轨的电阻均不计.金属棒在水平向右的恒定拉力作用下,在左面区域中恰好以速度为
,虚线为两区域的分界线.一根金属棒ab放在导轨上并与其正交,棒和导轨的电阻均不计.金属棒在水平向右的恒定拉力作用下,在左面区域中恰好以速度为![]() 做匀速直线运动,则:
做匀速直线运动,则:
A.若![]() =
=![]() 时,棒进入右面区域中后先做加速运动,最后以速度
时,棒进入右面区域中后先做加速运动,最后以速度![]() 作匀速直线运动
作匀速直线运动
B.若![]() =
=![]() 时,棒进入右面区域中时仍以速度
时,棒进入右面区域中时仍以速度![]() 作匀速直线运动
作匀速直线运动
C.若![]() =2
=2![]() 时,棒进入右面区域后先做减速运动,最后以速度
时,棒进入右面区域后先做减速运动,最后以速度![]() 作匀速运动
作匀速运动
D.若![]() =2
=2![]() 时,棒进入右面区域后先做加速运动,最后以速度4
时,棒进入右面区域后先做加速运动,最后以速度4![]() 作匀速运动
作匀速运动
22.实验(本题共2小题,共17分)
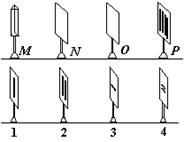 (1)(4分)英国物理学家托马斯·杨巧妙地解决了相干光源问题,第一次在实验室观察到了光的干涉现象.右图为实验装置简图,
(1)(4分)英国物理学家托马斯·杨巧妙地解决了相干光源问题,第一次在实验室观察到了光的干涉现象.右图为实验装置简图,![]() 为竖直线光源(长直灯丝钠灯)、
为竖直线光源(长直灯丝钠灯)、![]() 和
和![]() 均为有狭缝的遮光屏、
均为有狭缝的遮光屏、![]() 为像屏.现有四种不同带有狭缝的遮光屏,实验时的正确选择是( )
为像屏.现有四种不同带有狭缝的遮光屏,实验时的正确选择是( )
(A)![]() 应选1,
应选1,![]() 应选2
应选2
(B)![]() 应选3,
应选3,![]() 应选4
应选4
(C)![]() 应选1,
应选1,![]() 应选4
应选4
(D)![]() 应选3,
应选3,![]() 应选2
应选2
(2)(13分)从下列实验器材选择适当的器材,设计测量电路来测量两个电压表的内阻,要求方法简捷,操作方便,可进行多次测量并有尽可能高的测量精度.
A.待测电压表V1,量程3V,内阻约为12kΩ;
B.待测电压表V2,量程6V,内阻约为24kΩ;
C. 电流表A,量程3A,内阻r=0.5Ω
D.电阻箱R1,电阻值为0~9999.99Ω
E.电阻箱R2,电阻值为0~99.9Ω
F.滑动变阻器R3,0~1500Ω,额定电流1.5A;
G.滑动变阻器R4,0~20Ω,额定电流2A
H.电池组,电动势12V,内阻约为0.5Ω
此外还有单刀开关和导线若干供选用.
①请设计一个测量电路.画出实验电路图
②选出必要的器材,用器材前的字母表示,有
③需要测出哪些物理量,写出![]() 和
和![]() 的表达式.
的表达式.
23.(16分)某人将一质量为300g的钢球以一定的速度竖直向上抛出,1s后在同一高度将球接住,然后再以同样的速度在同一高度将球竖直向上抛出……,如此不断重复.此人在从接住球到抛出球的过程中,手先下降后又立即上升,高度的变化为25cm.试画出此人的手对球的作用力随时间变化的图象,并写出有关数值的推导计算过程.(从球抛出瞬间开始计时,取g=10m/s2,空气阻力可忽略不计,所有过程都可理想化为匀变速运动.)
24.(19分)如图所示,质量为m1=l㎏、长为L=2m的木板停放在光滑水平面上,在木板的右侧一定距离的竖直墙边放一轻质弹簧,质量为m2=2㎏的铁块(视为质点)以水平向右的速度![]() =5m/s滑上木板的左端,滑到木板的正中央时木板刚好接触到弹簧,此时木板速度为
=5m/s滑上木板的左端,滑到木板的正中央时木板刚好接触到弹簧,此时木板速度为![]() =2m/s.两者继续运动压缩弹簧,当弹簧被压缩到最短时,压缩量为S1=0.2m.此时铁块距离木板的右端为S2=0.2m.(不计木板与弹簧碰
=2m/s.两者继续运动压缩弹簧,当弹簧被压缩到最短时,压缩量为S1=0.2m.此时铁块距离木板的右端为S2=0.2m.(不计木板与弹簧碰 撞损失的机械能,且弹簧始终在弹性限度内).求:
撞损失的机械能,且弹簧始终在弹性限度内).求:
(1)木板刚好与弹簧接触时铁块的速度:
(2)铁块与木板间滑动摩擦力的大小:
(3)弹簧第一次被压缩到最短时的弹性势能.
![]()
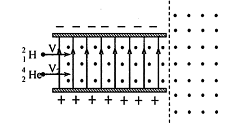 25.(20分)如图在两水平放置的平行金属板之间有向上的匀强电场,电场强度为E.在两板之间及右侧有垂直纸面向外的匀强磁场,磁感应强度均为B.有两个带电粒子
25.(20分)如图在两水平放置的平行金属板之间有向上的匀强电场,电场强度为E.在两板之间及右侧有垂直纸面向外的匀强磁场,磁感应强度均为B.有两个带电粒子![]() 、
、![]() (不计重力,不计粒子间的作用力),在同一竖直平面内以水平速度进入平行板,恰好都做匀速直线运动,射入点相距,(其中e为元电荷电量,m为质子质量).试求
(不计重力,不计粒子间的作用力),在同一竖直平面内以水平速度进入平行板,恰好都做匀速直线运动,射入点相距,(其中e为元电荷电量,m为质子质量).试求
(1)两带电粒子在右侧磁场中做圆周运动的半径
(2)要使两粒子在离开平行板后能相遇,则两粒子射入平行板的时间差△t=?
![]() 26. (14分)有下图所示的反应关系:A是中学化学中常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去。
26. (14分)有下图所示的反应关系:A是中学化学中常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去。
(1)若A与NaOH反应,既可生成B,也可生成C,还可生成B+C,写出符合上述反应关系的A的4种分子式
、
、
、
(2)若A与NaOH无论以何种比例反应,其产物均是B+C,则A的分子式可能是(只要求写一种)
(3)R在A、B、C中的化合价必须满足的条件是
27.(共18分)A、B、C是中学几种常见的化学实验装置图。
(1)在装置图A、B、C下面的空格中,分别填入能进行①~⑩实验的序号(多选倒扣分)
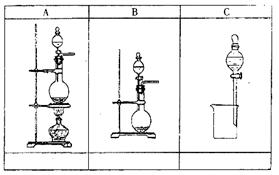 ①酒精和浓硫酸混合加热制乙烯
①酒精和浓硫酸混合加热制乙烯
②浓盐酸和二氧化锰混合加热制氯气
③分离苯和硝基苯的混合物
④用氯化钠和浓硫酸加热制取氯化氢
⑤浓硫酸跟亚硫酸钠制二氧化硫
⑥用浓硝酸跟铜反应制二氧化氮
⑦用饱和亚硝酸钠溶液跟饱和氯化铵溶液共热制氮气
⑧用电石跟水反应制乙炔
⑨分离乙酸和乙醇的混合物
⑩从溴水中用苯提取溴单质
(2)上述装置中,都使用了分液漏斗,其中真正起到分液作用的是 (填A或B或C)。 (3)用装置B制取少量气体时,烧瓶可用 代替(填一种仪器名称)
(4)若用装置B制备O2,在分液漏斗中盛放的试剂是 ,烧瓶中盛放的试剂是 发生反应的化学方程式: 。
(5)已知生石灰和浓氨水混合可以制备NH3,则实验装置应选 (填A或B或C),请简述理由:
 28.(16分)某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的支撑仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a-无水乙醇(沸点:78℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
28.(16分)某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的支撑仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a-无水乙醇(沸点:78℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
![]()

(1)简述三套方案各自的优点
甲:
乙:
丙:
(2)集中三套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为
(例如甲①,乙②,丙③)。
(3)若要保证此实验有较高的效率,还需补充的仪器有 理由 。
(4)实验中能验证乙醇氧化产物的实验现象是
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式 。
29.(12分)有机合成粘合剂是生产和生活中一类重要的材料,粘合的过程一般是呈液态的粘合剂小分子,经化学反应转化为大分子或高分子而固化。
![]() (1)“502胶”是一种快干胶,当暴露在空气中时,微量的水起催化作用,使其发生碳碳双键的加聚反应而迅速固化,几秒钟即可将被粘物牢牢粘在一起生成高分子化合物如图,请写出“502胶”小分子的结构简式
。
(1)“502胶”是一种快干胶,当暴露在空气中时,微量的水起催化作用,使其发生碳碳双键的加聚反应而迅速固化,几秒钟即可将被粘物牢牢粘在一起生成高分子化合物如图,请写出“502胶”小分子的结构简式
。
(2)厌氧胶(主要成分为CH2=CHCOOCH2CH2OOCCH=CH2)可在空气中长期储存,但在隔绝空气(缺氧)时,分子中的双键断开发生聚合而固化.在工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂.则这一制取过程的化学反应方程式为
(3)白乳胶发生粘合过程的化学机理与上述两种粘合剂相似,其主要成分为醋酸乙烯酯(CH3COOCH=CH2).醋酸乙烯酯含有—CH=CH—结构的同分异构体很多,但含有![]() 结构的物质不能稳定存在。除CH2=CHCOOCH3、HCOOCH=CH—CH3、HCOCH(OH)CH=CH2、HCOOCH=CH—CH3这些物质外,请写出另外符合上述要求、并且属于酯类物质的同分异构体的结构简式(任写2种):
、
结构的物质不能稳定存在。除CH2=CHCOOCH3、HCOOCH=CH—CH3、HCOCH(OH)CH=CH2、HCOOCH=CH—CH3这些物质外,请写出另外符合上述要求、并且属于酯类物质的同分异构体的结构简式(任写2种):
、
(4)已知:2CH3OH+HCHO—![]() CH3OCH2OCH3+H2O反应可以发生。聚乙烯醇(
CH3OCH2OCH3+H2O反应可以发生。聚乙烯醇(![]() )也是一种粘合剂,其水溶液可做普通胶水使用.它分子中的羟基可全部与丁醛发生脱水反应,得到含有六元环的高分子化合物,其粘合能力远比聚乙烯醇强,广泛应用于防弹玻璃、飞机舱玻璃的胶接,请写出该六元环粘合剂的结构简式:
。
)也是一种粘合剂,其水溶液可做普通胶水使用.它分子中的羟基可全部与丁醛发生脱水反应,得到含有六元环的高分子化合物,其粘合能力远比聚乙烯醇强,广泛应用于防弹玻璃、飞机舱玻璃的胶接,请写出该六元环粘合剂的结构简式:
。
30. (22分)下面是有关谷氨酸棒状杆菌培养的部分培养基配方。请回答:
| 无菌自来水 | NH4NO3 | MgSO4 | KNO3 | K2HPO4 | KH2PO4 |
| 1000mL | 5g | 1g | 1g | 0.2g | 0.2g |
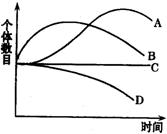 (1)如果用此培养基培养酵母菌,右图能表示在一段时间内酵母菌数量变化的曲线是 。
(1)如果用此培养基培养酵母菌,右图能表示在一段时间内酵母菌数量变化的曲线是 。
(2)酵母菌与谷氨酸棒状杆菌相比,在细胞结构上的主要区别是 。在基因结构上的主要区别是 。
(3)如果要通过发酵工程培养谷氨酸棒状杆菌来生产味精,上表配方中至少要加入 ,原因是
(4)当培养基的C/N比为4:1时,谷氨酸棒状杆菌生长迅速,而不积累谷氨酸。那么此时它的体内是否还合成谷氨酸? ;合成的话是用于 。
(5)若在此培养基的基础上,再加入某种成分,构成甲培养基;加入另一种成分,构成乙培养基。两培养基及其他培养条件都适合谷氨酸棒状杆菌生长。现从甲中取少量处于对数期的细菌,接种在乙中。则在接种后的最初一段时间内,细菌在乙中的状况与原先在甲中的状况相比,不会改变的是 。(选择)
A.组成酶种类 B.诱导酶种类 C.mRNA种类 D.细胞的大小
31. (20分)小麦品种是纯合体,生产上用种子繁殖,现要选育矮杆(aa)、抗病(BB)的小麦新品种;马铃薯品种是杂合体(有一对基因杂合即为杂合体),生产上通常用块茎繁殖。现要选育黄肉(Yy)、抗病(Rr)的马铃薯新品种。请分别设计小麦品种间杂交育种程序,以及马铃薯品种间杂交育种程序。要求用遗传图解表示并加以简要说明。(写出包括亲本在内的前三代即可)