08级高三理综第六次大检测试题
命题: 物理 杨永宏 化学 朱玲明 生物 苟强林 组卷 苟强林
(总分:300分,时间:150分钟)
第 I 卷
`本卷共 21 小题,每小题 6 分,共 126 分。
一、单项选择题(共13小题,每小题6分)
1.下列有关遗传与基因工程的叙述中,正确的是
A.同一生物体不同体细胞的核基因和质基因的数量都相同
B.测定人类单倍体基因组和二倍体水稻(2n=24)单倍体基因组时,各需测定24条和13条染色体上DNA分子的脱氧核苷酸序列
C.目的基因导入受体植物细胞并整合到叶绿体基因中,不会通过花粉传递至近缘作物
D.转基因抗虫棉的抗虫基因与棉花基因的基因结构是相同的
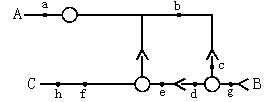
2.下图表示三个神经元及其联系.其中“—○—<”表示从树突到胞体再到轴突及末梢,则下列叙述正确的是
A.若有两个与感受器相连的部位,则可是A和C。图中共有3个完整的突触
B.在f点施加一强刺激,则f点的膜电位变为外正内负,并在b点可测到电位变化
C.对该反射弧来说,大脑皮层对其活动不会产生影响
D.位于身体内部的部分神经结构是由原肠胚的中胚层发育来的
3. 天花是一种传染性强,病死率高的疾病。我国早在宋朝真宗时期就已经采用接种人痘——即将轻症天花病人脓疱中的浆液(简称痘浆),接种于健康人的方法来预防天花。下列说法正确的是
A.引起天花的病原体生物可在含有5种营养要素的基本培养基中扩大培养
B.从免疫学上看,接种痘浆实际上是将相应抗体接种,增强易感人群的免疫力
C.将天花的病原体生物与人骨髓瘤细胞融合得到杂交瘤细胞,可以制备相应单克隆抗体
 D.天花病原体生物不含核糖体等细胞器,不能独立进行新陈代谢
D.天花病原体生物不含核糖体等细胞器,不能独立进行新陈代谢
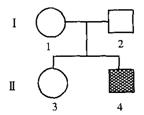
4.如图是人类某种遗传病的系谱图,Ⅱ4为患者。排除多基因遗传病和染色体异常遗传病且不考虑基因突变的情况下,下列相关叙述有错误的是
A.该病属于隐性遗传病,但致病基因不一定在常染色体上,
Ⅱ3是携带者的概率为1/2
B.该病一定不是细胞质遗传病
C.若I2携带致病基因,则Il与I2再生一患病男孩的概率为1/8
D.若Ⅱ3不携带致病基因,则Il的一个初级卵母细胞中含2个致病基因
5.将一株盆栽玉米放在特定的实验装置内,研究温度对光合作用与呼吸作用的影响(其余的实验条件都是理想的),实验以CO2的吸收量与释放量为指标。实验结果如下表所示:
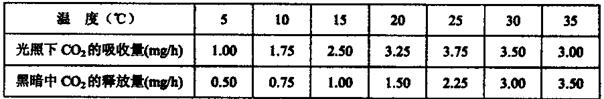
下列有关叙述中,错误的是
A.在光照充分的条件下,适当增大昼夜温差,可提高该植物产量
B.若恒温条件下每天交替12h光照、12h黑暗,25℃时积累有机物最多
C.光合作用过程中酶的最适温度比呼吸作用过程酶的最适温度低
D.在光照下CO2首先转移到C4化合物中,然后才转移到C3化合物中
6. 在恒温恒容条件下,能使A(g)+B(g)![]() C(g)+D(g)正反应速率增大的措施是
C(g)+D(g)正反应速率增大的措施是
A.减小C或D的浓度 B.增大D的浓度
C.减小B的浓度 D.增大A或B的浓度
7. 一种化学冰袋中含有Na2SO4·10H2O(96 g)、NH4NO3(50 g)、(NH4)2SO4(40 g)、NaHSO4(40 g)。将Na2SO4·10H2O和其他三种盐分别盛于两只塑料袋中,用时使它们混合并用手搓揉就可制冷,制冷效果能维持2—3 h。以下关于制冷剂原因的猜测肯定错误的是
A.Na2SO4·10H2O脱水是吸热过程
B.较长时间制冷是由于Na2SO4·10H2O脱水是较慢的过程
C.铵盐在该条件下发生复分解反应是吸热过程
D.NH4NO3溶于结晶水会吸收热量
8. 设NA表示阿伏加德罗常数值,下列说法正确的是
A.1 L 1 mol·L-1 CH3COONa溶液中存在NA个CH3COO-
B.1 mol CnH2n+2含有(3n+1)NA个共价键
C.1 mol Cl2参加化学反应获得的电子数都是2NA
D.1 mol NO2气体降温后颜色变浅,其所含的分子数仍为NA
9. 下列事实能用同一原理来解释的是
A. 福尔马林、葡萄糖与Cu(OH)2共热时都有红色沉淀生成
B.NH4Cl晶体、固态碘受热时都会汽化
C. 二氧化硫、氯气都能使品红溶液褪色
D.苯酚、乙烯都能使溴水褪色
10. 近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470 ℃、80 MPa下合成出金刚石,具有深远意义。下列说法不正确的是
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
11. 第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要。下列关于天然气水合物中两种分子极性的描述正确的是
A.两种都是极性分子 B.两种都是非极性分子
C.CH4是极性分子,H2O是非极性分子 D.H2O是极性分子,CH4是非极性分子
12. 在下列过程中,需要增大化学反应速率的是( )
A.钢铁腐蚀 B.食物腐败 C.塑料老化 D.工业合成氨
13. 进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
A.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应
B.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色物质生成且能溶于浓硝酸
C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明含硫酸根离子
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
二、选择题(本题包括 8 小题。每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得 6 分,选对但不全的得 3 分,有选错的得 0分)
 14.康普顿效应证实了光子不仅具有能量,也有动量.右图给出了光子与静止电子碰撞后,电子的运动方向,则碰后光子:
14.康普顿效应证实了光子不仅具有能量,也有动量.右图给出了光子与静止电子碰撞后,电子的运动方向,则碰后光子:
A.可能沿1方向,且波长变小 B.可能沿2方向,且波长变小
C.可能沿1方向,且波长变长 D.可能沿3方向,且波长变长
 15. 如图,弹簧下面挂一质量为m的物体,物体在竖直方向上作振幅为A的简谐运动,当物体振动到最高点时,弹簧正好为原长.则物体在振动过程中
15. 如图,弹簧下面挂一质量为m的物体,物体在竖直方向上作振幅为A的简谐运动,当物体振动到最高点时,弹簧正好为原长.则物体在振动过程中
A.物体在最低点时的弹力大小应为mg
B.弹簧的弹性势能和物体动能总和不变
C.弹簧的最大弹性势能等于2mgA
D.物体的最大动能应等于mg
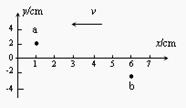 16.如图,一列简谐横波沿x轴负方向传播,振幅A=4cm。在t=0时刻,平衡位置相距5cm的两质点a、b的位移分别是2cm、-2cm,它们的运动方向都沿y轴的负方向。则
16.如图,一列简谐横波沿x轴负方向传播,振幅A=4cm。在t=0时刻,平衡位置相距5cm的两质点a、b的位移分别是2cm、-2cm,它们的运动方向都沿y轴的负方向。则
A.t=0时刻,a、b两质点的动能相同
B.a质点速度为零时,b质点速度不为零
C.当a质点到达平衡位置时,b质点恰好到达负最大位移处
D.a、b两质点的平衡位置间的距离为半波长的奇数倍
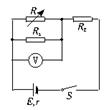 17.关于第一宇宙速度,下面说法中错误的是
17.关于第一宇宙速度,下面说法中错误的是
A. 它是人造地球卫星绕地球飞行的最大速度
B. 它是近地圆形轨道上人造地球卫星的运行速度
C. 它是能使卫星进入近地圆形轨道的最小发射速度
D. 它是卫星在椭圆轨道上运行时在近地点的速度
18.下列说法正确的是
A .物体分子间距离减小,分子力一定增大
B .物体分子间距离增大,分子势能可能增大
C .物体从外界吸收热量,其内能一定增大
D .质量、温度均相等的两个物体,它们的内能可能不相等
19 .调整如图所示电路的可变电阻R的阻值,使电压表V的示数增大ΔU,在这个过程中
A.通过R1的电流增加,增加量一定等于ΔU/R1
B.R2两端的电压减小,减少量一定等于ΔU
C.通过R2的电流减小,但减少量一定小于ΔU/R2
D.路端电压增加,增加量一定等于ΔU
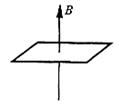 20.如图所示,闭合金属导线框放置在竖直向上的匀强磁场中,匀强磁场的磁感应强度的大小随时间变化.下列说法
20.如图所示,闭合金属导线框放置在竖直向上的匀强磁场中,匀强磁场的磁感应强度的大小随时间变化.下列说法
A.当磁感应强度增加时,线框中的感应电流可能减小
B.当磁感应强度增加时,线框中的感应电流一定增大
C.当磁感应强度减小时,线框中的感应电流一定增大
D.当磁感应强度减小时,线框中的感应电流可能不变
21 .在金属中存在大量的价电子(可理解为原子的最外层电子),价电子在原子核和核外的其他电子产生的电场中运动.电子在金属外部时的电势能比它在金属内部作为价电子时的电势能大,前后两者的电势能差值称为势垒,用符号 V 表示.价电子就像被关在深为 V 的方箱里的粒子,这个方箱叫做势阱,价电子在势阱内运动具有动能,但动能的取值是不连续的,价电子处于最高能级时的动能称为费米能,用
Ef表示.用红宝石激光器向金属发射频率为![]() 的光子,具有费米能的电子如果吸收了一个频率为
的光子,具有费米能的电子如果吸收了一个频率为![]() 的光子而跳出势阱,则
的光子而跳出势阱,则
A .具有费米能的电子跳出势阱时的动能 EK=h![]() -V + Ef
-V + Ef
B .具有费米能的电子跳出势阱时的动能EK=h![]() -V-Ef
-V-Ef
C .若增大激光器的发光强度,具有费米能的电子跳出势阱时的动能增大
D .若增大激光器的发光强度,具有费米能的电子跳出势阱时的动能不变
第II卷
三.非选择题。本卷共 10 题,共 174 分。
22.某同学按下图所示电路进行实验,实验时该同学把变阻器的触片P移到不同位置时测得各电表的示数如下表所示,将电压表内阻看作无限大,电流表内阻看作零.
| 序号 | A1示数(A) | A2示数(A) | V1示数(V) | V2示数(V) |
| 1 | 0.62 | 0.30 | 2.41 | 1.21 |
| 2 | 0.45 | 0.32 | 2.55 | 0.49 |
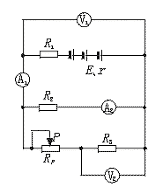 (1)电路中E、r分别为电源的电动势和内阻,R1、R2、R3为定值电阻,在这五个物理量中,可根据上表中的数据求得的物理量是(不要求具体计算)
;
(1)电路中E、r分别为电源的电动势和内阻,R1、R2、R3为定值电阻,在这五个物理量中,可根据上表中的数据求得的物理量是(不要求具体计算)
;
(2)由于电路发生故障,发现两电压表的示数相同(但不为零),若这种情况的发生是由电阻故障引起的,则可能的故障原因是 .
(3) 如图7所示,某同学在做“研究匀变速直线运动”实验中,由打点计时器得到表示小车运动过程的一条清晰纸带,纸带上两相邻计数点的时间间隔为T=0.10s,其中S1=7.05cm、S2=7.68cm、S3=8.33cm、S4=8.95cm、S5=9.61cm、S6=10.26cm,则A点处瞬时速度的大小是_______m/s,小车运动的加速度计算表达式为_______,加速度的大小是_______m/s2(计算结果保留两位有效数字)。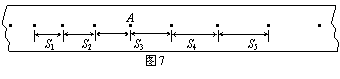

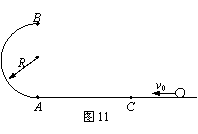 23.(12分)如图11所示,半径R=0.40m的光滑半圆环轨道处于竖直平面内,半圆环与粗糙的水平地面相切于圆环的端点A。一质量m=0.10kg的小球,以初速度v0=7.0m/s在水平地面上向左作加速度a=3.0m/s2的匀减速直线运动,运动4.0m后,冲上竖直半圆环,最后小球落在C点。求A、C间的距离(取重力加速度g=10m/s2)。
23.(12分)如图11所示,半径R=0.40m的光滑半圆环轨道处于竖直平面内,半圆环与粗糙的水平地面相切于圆环的端点A。一质量m=0.10kg的小球,以初速度v0=7.0m/s在水平地面上向左作加速度a=3.0m/s2的匀减速直线运动,运动4.0m后,冲上竖直半圆环,最后小球落在C点。求A、C间的距离(取重力加速度g=10m/s2)。
24.如图所示,矩形导线框abcd固定在水平面上,ab=L、bc=2L,整个线框处于竖直方向的磁感应强度为B的匀强磁场中。导线框上ab、cd段电阻不计,bc、ad段单位长度上的电阻为λ。今在导线框上放置一个与ab边平行且与导线框接触良好的金属棒MN,其电阻为r(r<λL)。金属棒在外力作用下沿x轴正方向做速度为v的匀速运动,在金属棒从导线框最左端(x=0)运动到最右端的过程中:
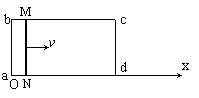 ⑴请导出金属棒中的感应电流I随x变化的函数关系式;
⑴请导出金属棒中的感应电流I随x变化的函数关系式;
⑵通过分析说明金属棒在运动过程中,MN两点间电压有最大值,并求出最大值Um;
⑶金属棒运动过程中,在什么位置MN的输出功率最大?并求出最大输出功率Pm。
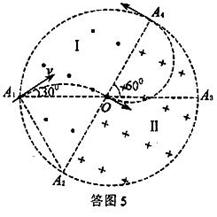
25、如图12所示,在一个圆形区域内,两个方向相反且都垂直于纸面的匀强磁场分布在以直径A2A4为边界的两个半圆形区域Ⅰ、Ⅱ中,A2A4与A1A3的夹角为60º。一质量为m、带电量为+q的粒子以某一速度从Ⅰ区的边缘点A1处沿与A1A3成30º角的方向射入磁场,随后该粒子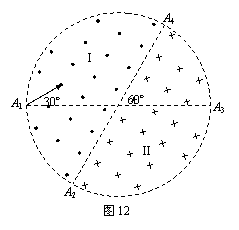 以垂直于A2A4的方向经过圆心O进入Ⅱ区,最后再从A4处射出磁场。已知该粒子从射入到射出磁场所用的时间为t,求Ⅰ区和Ⅱ区中磁感应强度的大小(忽略粒子重力)。
以垂直于A2A4的方向经过圆心O进入Ⅱ区,最后再从A4处射出磁场。已知该粒子从射入到射出磁场所用的时间为t,求Ⅰ区和Ⅱ区中磁感应强度的大小(忽略粒子重力)。
26.(18分) 测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,可以准确求出原溶液中I-的浓度。主要步骤如是:
①取100mL样品溶液,用单质溴将样品中的I-氧化成IO![]() ,将过量的溴除去。
,将过量的溴除去。
②再加入过量的KI,并用硫酸酸化,使IO![]() 完全转化成I2。
完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-。
④将生成的I-萃取到水层后,用步骤①的方法再处理转化为IO![]() 。
。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化,使IO![]() 完全转化成I2。
完全转化成I2。
⑥将⑤得到的溶液完全转入250mL容量瓶,并加水稀释至刻度。
⑦分别取⑥得到的溶液25.00mL于锥形瓶中,加入指示剂,用0.1010mol/L 的Na2S2O3标准溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI)。
⑧重复操作⑦两次。
根据上述步骤回答下列问题:
(1)在操作①中,除去过量溴单质的方法是 。
(2)请写出操作②中发生的反应的离子方程式 。
(3)在萃取操作中,使用的玻璃仪器有 。步骤⑦使用的指示剂是 ;判断滴定达到终点的现象为 。
(4)下表是该实验的记录结果:
| 滴定 次数 | 待测溶液的体积 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.05 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.11 | 20.09 |
原溶液中I-的物质的量浓度为 。
27.(18分) 下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
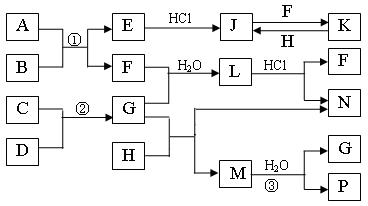
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是 。
(2)F的化学式 ;G的水溶液中,最多的阳离子是 。
(3)写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释
。
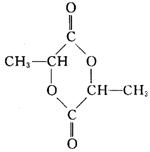
28. (12分)由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。
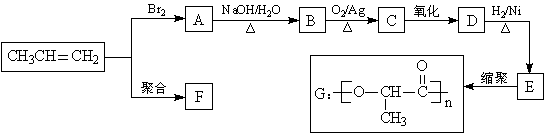
(1)聚合物F的结构简式是_____________________________________。
(2)D的结构简式是___________________________________________。
(3)B转化为C的化学方程式是__________________________________________________。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是____________________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属
钠反应产生1mol H2,则该种同分异构体为____________________________。
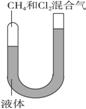 29.(12分))如下图所示,一端封闭的U形管,封闭的一端有CH4和Cl2的混合气体,U形管中的液体不参与反应,也不溶解反应物和生成物。使CH4和Cl2的混合气体(体积比1∶3充入)在可见光照射下缓慢反应一段时间。
29.(12分))如下图所示,一端封闭的U形管,封闭的一端有CH4和Cl2的混合气体,U形管中的液体不参与反应,也不溶解反应物和生成物。使CH4和Cl2的混合气体(体积比1∶3充入)在可见光照射下缓慢反应一段时间。
(1)写出甲烷与氯气反应的化学方程式(只写1个即可):___________。
(2)反应数小时后,U形管右侧(开放端)液体的液柱高度将( )
A.升高 B.下降 C.不变 D.难以确定
(3)对(2)的结论作一简要分析。
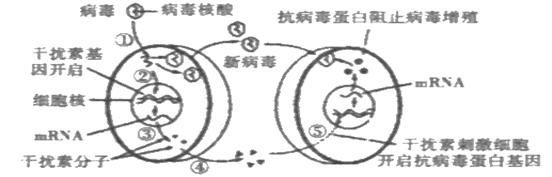 30. Ⅰ(14分) 病毒侵入人体后,机体会产生微量高效的干扰素,以抵抗病毒的攻击。下图是机体细胞产生干扰素以及干扰素发挥作用的示意图。请结合示意图回答下列问题:
30. Ⅰ(14分) 病毒侵入人体后,机体会产生微量高效的干扰素,以抵抗病毒的攻击。下图是机体细胞产生干扰素以及干扰素发挥作用的示意图。请结合示意图回答下列问题:
(1)图中产生干扰素的细胞最可能是人体内的 细胞,该细胞可由
增殖分化而来。
(2)图中阻止病毒增殖的物质是抗病毒蛋白质,而在人体内环境中阻止病毒播散的物质是 。
(3)现在已用基因工程方法生产干扰素。如果利用大肠杆菌来生产人的干扰素,那么目的基因是 ,最佳的运载体是 。
(4)乙肝和丙肝分别由乙肝病毒(HBV,DNA病毒)和丙肝病毒(HCV,RNA病毒)引起。干扰素对乙肝和丙肝均有一定的疗效。
①乙肝和丙肝均可能最终导致肝癌,这属于引起细胞癌变的 致癌因子。
②科学家发现干扰素对丙肝的疗效与患者本身某些基因的表达有一定关系。预测干扰素疗效的基因芯片(含有DNA分子探针)利用 原理,可以测试患者相关基因的表达状态,为选择干扰素最佳用药方法提供依据。
II.目前城市污水处理的常用方法之一是“生物膜”法:将一系列圆盘结构下半部浸没于污水中,上半部敞露在空气中并不断地旋转,很快就在圆盘上形成了“生物膜”。这种生物膜是由细菌、真菌、原生动物等构成的微生物群落。扫描电镜下可以发现,典型的生物膜有两层结构,外层主要由丝状菌等组成,内层由脱硫弧菌等组成。这样的“生物膜”能有效去除污水中的大部分有机物及硫酸盐等无机物。
(1)根据材料可以分析得出,丝状菌、脱硫弧菌的代谢类型分别是____ ______,其分解有机物时产生的[H]的去向是___________ ________。
(2)此处的“生物膜”与细胞结构中的生物膜有着本质上的区别,后者的主要组成物质是_____ ______,人们曾根据这种生物膜设计出淡化海水或去除污水中的重金属离子的膜材料,这是依据了生物膜的___ ____性。
(3)取出该“生物膜”中的某种细菌A,进行了如下的四项实验:
实验I:将A接种于培养基上,结果出现菌落。
实验II:用另一剂量的紫外线处理A,得到突变种a1,将其接种于培养基后,不出现菌落;但在培养基内添加物质甲后,就出现菌落。
实验III:用另一剂量的紫外线处理A,得到突变种a2,将其接种于培养基后,不出现菌落;但在培养基内添加营养物质乙后,就出现菌落。
实验IV:将a1和a2一起接种于培养基上,数日后出现菌落。
分析回答下列问题:
①细菌a1和a2分别培养,均不能生长。其原因是用紫外线处理导致细菌A发生了____ ____,从而无法合成物质甲和乙。
②实验I、II、III表明,物质甲和乙均是细菌A的代谢过程中产生的_____ 代谢产物。在实验II中,它们是作为____ ___(营养要素)添加到培养基中。
③实验IV中出现菌落的原因是_______ ____________。
31.(20分)
I.下表是Khorana为破译密码子进行的实验结果。他用人工合成的mRNA,在细胞外的转译系统中合成多肽,然后分析合成的多肽中氨基酸的组成。请分析回答:
| 实验序号 | 重复的mRNA顺序 | 生成的多肽所含氨基酸种类 |
| 1 | (UC)n | 丝氨酸、亮氨酸 |
| 2 | (UUC)n | 苯丙氨酸、亮氨酸、丝氨酸 |
| 3 | (UUAC)n | 亮氨酸、苏氨酸、酪氨酸 |
说明:表中(UC)n表示UCUCUCUCUCUCUC……这样的重复mRNA顺序。
(1)细胞外的转译系统中除加入全套必要的酶系统、tRNA、人工合成的mRNA和20种氨基酸外,还需提供 和 。
(2)通过分析实验中可能出现的密码子以及生成的多肽中氨基酸组成的比较,可以得出亮氨酸的密码子是 ;
(3)通过对实验3所形成的密码子种类与氨基酸种类的分析可得出的结论是
。
 (4)酪氨酸在酪氨酸酶催化下可合成黑色素,酪氨酸酶的合成是受基因控制的,当基因型为aa时表现为白化,而基因型为Aa(杂合体)的个体却表现正常。试分析杂合体表现正常的原因:
(4)酪氨酸在酪氨酸酶催化下可合成黑色素,酪氨酸酶的合成是受基因控制的,当基因型为aa时表现为白化,而基因型为Aa(杂合体)的个体却表现正常。试分析杂合体表现正常的原因:
。
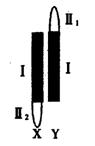
II.自然界的大麻为雌雄异株植物,其性别决定方式为XY型。右图为其性染色体简图。X和Y染色体有一部分是同源的(图中的I片断),该部分基因互为等位 另一部分是非同源的(图中的II1,II2片断),该部分基因不互为等位。在研究中发现,大麻种群中雌雄个体均有抗病和不抗病的个体存在,已知抗病性状受显性基因B控制。
(1)由题中的信息可知,控制大麻的抗病基因不可能位于图中的______段。
(2)大麻雄株在减数分裂形成配子过程中,不可能通过互换发生基因重组的是图中的__ ____片断。
(3)现有抗病的雌雄大麻若干株,只做一代杂交实验,推测杂交子一代可能出现的性状,并以此为依据,对控制该性状的基因位于哪个片段【除第(1)问中的片段】作出相应的推断。(要求:只写出子一代的性状表现和相应的推断的结论)_______________
______ 。
(4)通过实验已确定控制该性状基因位于II2片断上,若想通过杂交实验培养一批在生殖生长之前就能识别雌雄的植株,则选择的亲本杂交产生的子代中雄性植株的表现型为__________,其基因型为______________。
物理参考答案
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 答案 | C | C | AB | AD | BD | AC | AD | AD |
22、(1)E1 R2 R3 (2)R3断路或RP短路
(3)0.86,![]() ,0.64
,0.64
23 匀减速运动过程中,有:![]() (1)
(1)
恰好作圆周运动时物体在最高点B满足:mg=m![]()
![]() =2m/s (2) 假设物体能到达圆环的最高点B,由机械能守恒:
=2m/s (2) 假设物体能到达圆环的最高点B,由机械能守恒:
![]() (3)
(3)
联立(1)、(3)可得 ![]() =3m/s
=3m/s
因为![]() >
>![]() ,所以小球能通过最高点B。
,所以小球能通过最高点B。
小球从B点作平抛运动,有:2R=![]() (4)
(4)
![]() (5)由(4)、(5)得:
(5)由(4)、(5)得:
![]() =1.2m
(6)
=1.2m
(6)
24、(1)![]()
![]() (2)Um=
(2)Um=![]()
 (3)
(3)![]() Pm=
Pm=![]()
25. 设粒子的入射速度为v,已知粒子带正电,故它在磁场中先顺时针做圆周运动,再逆时针做圆周运动,最后从A4点射出,用B1、B2、R1、R2、T1、T2分别表示在磁场Ⅰ区Ⅱ磁感应强度、轨道半径和周期
![]() ①
①
![]() ②
② ![]() ③
③
![]() ④
④
设圆形区域的半径为r,如答图5所示,已知带电粒子过圆心且垂直A3A4进入Ⅱ区磁场,连接A1A2,△A1OA2为等边三角形,A2为带电粒子在Ⅱ区磁场中运动轨迹的圆心,其半径
![]() ⑤
⑤
圆心角![]() ,带电粒子在Ⅰ区磁场中运动的时间为
,带电粒子在Ⅰ区磁场中运动的时间为
![]() ⑥
⑥
带电粒子在Ⅱ区磁场中运动轨迹的圆心在OA4的中点,即
R=![]() r
⑦
r
⑦
在Ⅱ区磁场中运动时间为
![]() ⑧
⑧
带电粒子从射入到射出磁场所用的总时间
![]() ⑨
⑨
由以上各式可得
![]() ⑩
⑩
![]() 11
11
化学参考答案(6)
6.D7.C 8.B 9.A 10.B 11.D 12.D 13.B
26.(18分)1)多次萃取或将溶液加热煮沸
(2)5I-+IO![]() +6H+==3I2+3H2O
+6H+==3I2+3H2O
(3)烧杯、分液漏斗 淀粉试液 滴入最后一滴Na2S2O3,溶液由蓝色变为无色,且30s不恢复
(4)5.611×10-3mol/L
27.(18分)(1)S、Fe
(2)SO2 NH4+
(3)2Fe2++ Cl2=2 Fe3+ + 2Cl- 4NH3+3Cl2=NCl3+3NH4Cl
(4)饱和H水溶液中存在平衡:Cl2+H2O![]() H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
28. (1)![]()
(2)![]()
(3)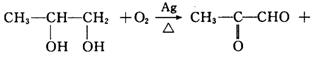
![]()
(4)
29.(12分) (1)CH4+3Cl2![]() CHCl3+3HCl(其他合理反应亦可)
CHCl3+3HCl(其他合理反应亦可)
(2)B
(3)左侧发生反应,气体体积减小、气压减小、液面上升,故右侧液面下降。
生物部分参考答案:
1-5:C A D A B
30.(22分)Ⅰ(每空2分,共14分)(1)效应T细胞 T淋巴细胞或记忆细胞
(2)抗体 (3)人的干扰素基因 大肠杆菌的质粒
(4)①病毒 ②DNA分子与RNA分子杂交
Ⅱ(每空1分,共8分)(1)异养需氧型、异养厌氧型(1分);与O2结合生成水 (1分)
(2)蛋白质和磷脂分子(1分) 选择透过性(1分)
(3)①基因突变 (1分);②初级(1分);生长因子(1分);③细菌a1能合成营养物质乙,细菌a2能合成营养物质甲(或两者分别能合成对方所不能合成的营养物质)(1分)
31.(每空2分,共20分)
I.(1)核糖体 ATP (2)CUU、CUC (3)一种氨基酸可以有多个密码子
(4)①体细胞中基因成对存在 ②只要有一个A(或显性基因)存在,便可控制合成酪氨酸酶 ③a基因不能控制合成酪氨酸酶。(只要答到②就给全分)
II.(1)II1 (2)II1和II2 (3)如果子一代中的雌雄株多数表现为抗病性状,少数不抗病,则控制该性状的基因位于图中的I片断。如果子一代中的雌株均表现为抗病性状,雄株多数表现为抗病性状,少数不抗病,则控制该性状的基因位于图中的II2片断
(4)不抗病 XbY
理科综合第六次大检测答题卷
| 1 | 2 | 3 | 4 | 5 | 生 | 6 | 7 | 8 | 9 | 10 | 11 |
| 12 | 13 | 化 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 物 |
22.(1) (2)
(3)
23.
24.
25.
26.26.(18分)
(1) 。
(2) 。
(3) 。 ;
。
(4) 。
27.(18分)(1) 。
(2) ; 。
(3) ; 。
(4)
。
28.(12分)(1)
(2)
(3)
(4)
29.(12分)(1)
(2)
(3)
30.Ⅰ(1)
(2) (3)
(4)① ②
II(1)____ ______ ___________ ________
(2)_____ ______ ___ ____
(3)①____ ____ ②_____ ____ ___
③_______ ______。
31.(20分)
I.(1) (2)
(3)
(4)
II.(1)______(2)__ ____
(3)_______________
___ 。
(4)__________ ______________