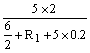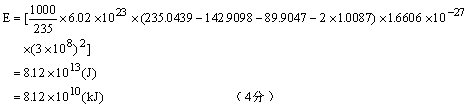| 高考理科(综合)测试题 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
一、选择题:(本题共18小题,每小题5分,计90分。每小题至少有一个选择题支是正确的, 全选对得5分,不选及少选、多选及错选均得零分) 1、如图所示,水平地面上叠放着A、B两长方形物块,F0是作用在物块B上的水平恒力,物块A、B以相 同的速度作匀速直线运动,若在运动中突然将F0改为作用在物块A上,则此后的运动可能的是 [ ]
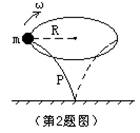
2、质量不计的轻质弹性杆P插在桌面上,杆端套有一个质量为m的小球,今使小球沿水平方向作半径 为R的匀速圆周运动,角速度为ω,如图所示,则杆的上端受到的作用力大小为 [ ]
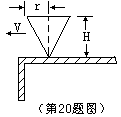
3、如图所示,1、2、3……10各点之间的距离均是1m。当t=0时,点1开始向上振动,经0.1S达到最大 位移,而振动向右传播至点3,则以下结论正确的是 [ ]
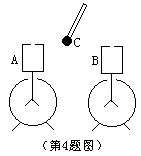
4、如图所示,验电器A与B的顶端各安装了一个上端开有小孔的金属圆筒,验电器B带有正电荷,用带 有绝缘柄的金属小球C,在下列操作中能将B上的电荷尽量多的搬至A的是 [ ]
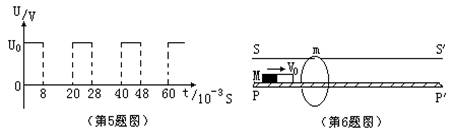
5、给额定功率60W、额定电压220V的白炽灯加上如图所示的电压,恰使灯正常发光,则所加电压U0的 大小约为 [ ] A、220V B、310V C、350V D、440V 6、如图所示,一根足够长的水平滑杆SS′上套有一质量为m的光滑金属圆环,在滑杆的正下方与其平 行放置一足够长的光滑水平的木制轨道PP′,PP′穿过金属环的圆心,现使质量为M的条形磁铁以水平速 度V0沿木制轨道向右运动,设磁铁与圆环的最后速度分别为VM和Vm,则 [ ] A、磁铁穿过金属环后,两者将先后停下来
C、一定有VM≥Vm D、可能有VM<Vm
表示3min内的化学反应速率。下列说法正确的是 [ ] A、VA=0.4 mol·(L·min)-1 B、VB=0.3 mol·(L·min)-1和VC=0.1 mol·(L·min)-1,表示的是同一反应速率 C、2min末的反应速率,用B表示是0.3 mol·(L·min)-1 D、VB∶VC∶VD=3∶1∶2 8、下列有关推断中不符合实际的是 [ ] A、第n周期中有2n2种元素 B、第n周期第n族(n>1)的元素一定是金属元素 C、第n周期有(8-n)种非金属元素(n>1,包括希有气体元素) D、第n周期第n族的元素一定是非金属元素 9、下列说法中正确的是(NA表示阿伏加德罗常数) [ ] A、NA个N2分子和NA个CO分子所含的电子数相等 B、在标准状况下 ,11.2L氖气中含有NA个氖原子 C、2 mol·L-1 Na2SO4溶液中含有4NA个Na+ D、NA个水分子的相对分子质量之和等于水的摩尔质量 10、单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿 (FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
⑤TiCl4+2Mg=2MgCl2+Ti 下列叙述错误的是 [ ] A、反应①是非氧化—还原反应 B、反应②是水解反应 C、反应④中TiO2是氧化剂 D、反应⑤表现了金属镁还原性比金属钛强 11、某烃具有两种或两种以上的同分异构体,在同分异构体中的某一种只能有一种一氯代物,这种烃 可能是:①具有C7的芳香烃,②具C10的稠环烃,③具C4的烷烃,④具C5的烷烃,⑤具C6的烷烃,⑥具C8 的烷烃 [ ] A、①②④ B、④⑤⑥ C、仅④⑥ D、③④⑤⑥ 12、在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3④Na2S。所含 带电微粒数由多到少的顺序是 [ ] A、①=④>③=② B、④>①>③>② C、①>④>③>② D、④=①>③>② 13、如下图,有4根月季枝条,将它们扦插后,哪根枝条能成活,且其下 端生出的根较多? [ ]
14、环境污染已成为人类社会面临的重大威胁,下列与环境污染无关的是 [ ] A、温室效应 B、赤潮 C、光化学污染 D、酸雨 E、臭氧空洞 F、水俣病 G、潮汐 H、大脖子病 I、水华 15、已知番茄红果(B)对黄果(b)是显性。用红果番茄和黄果番茄杂交,所得F1代基因型为Bb,让 F1代植株自交,共获1200个番茄,从理论上分析,有黄果番茄 [ ] A、1200个 B、900个 C、300个 D、0个 16、在将显微镜的低倍镜转换成高倍镜并寻找物象的过程中,应出现的操作过程是 [ ] A、转动细调节器 B、转动粗调节器 C、转动转换器 D、调节反光镜和光圈 17、下列四个细胞中,含有二个染色体组的细胞是 [ ]
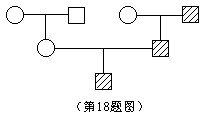
18、下图是某家族遗传系谱,其中可能的遗传方式是 [ ]
A、常染色体显性遗传 B、常染色体隐性遗传 C、X染色体显性遗传 D、Y染色体遗传 二、填空题:(本题共10小题,每小题4分,计40分) 19、海市蜃楼是光在密度分布不均匀的空气中传播时发生 而产生的。在沙漠里,太阳照射到沙上, 使接近沙面的热空气比上层空气密度小,因而在沙漠里看到海市蜃楼现象时,人们看到的是远处物体的 。
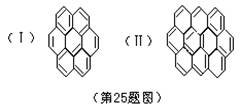
23、下列实验中所选用的仪器合理的是 。 A、用200mL量筒量取5.2mL稀硫酸 B、用100mL烧杯配制100g质量分数为1%的食盐水 C、用托盘天平称量11.7g氯化钠晶体 D、用酸式滴定管量取25.12mL某高锰酸钾溶液 E、用瓷坩埚灼烧各种钠的化合物 F、用250mL容量瓶配制250mL 0.2mol·L-1的氢氧化钠溶液 24、氮化硼(BN)是一种新型的无机高分子材料,与石墨具有相似的结构和性质,常用作高温下的润 滑剂。 (1)BN具有 形的平面网状结构。 (2)若氮化硼中含有n个硼原子,则最小的环有 个。 25、有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃。下列椭圆烯 也属于稠环芳香烃。 据此回答:
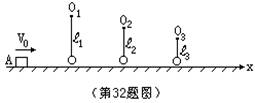
(1)已知椭圆烯(Ⅰ)的分子式为C24H12,则椭圆烯(Ⅱ)的分子式为 。 (2)上述椭圆烯的一氯取代物各有几种同分异构体? (Ⅰ)有 种,(Ⅱ)有 种。 (3)假如上述椭圆烯可以和氢气在一定条件下发生加成反应生成饱和脂环烃,则加氢后的生成物分 子中所有的碳原子是否仍在同一平面内? 。 26、化合物A是天然蛋白质的最终水解产物,化合物B是一种含有醛基的硝酸酯,A、B两物质的分子式 都可用CaHbOcNd(且a+c=b,a-c=d)表示。试回答: (1)A、B两物质的分子式是 。 (2)光谱测定显示A的分子结构中不存在甲基(-CH3),则A的结构简式是 ;光谱测定显示为B 的烃基部分不存在支链,则B的结构简式是 。 27、奥巴林在做“生命起源”模拟实验时 ,将白明胶和阿拉伯胶的水溶液混在一起,发现原来均匀 透明的液体变得浑浊,而在显微镜下观察,浑浊的液体中有许多小滴,它与周围有明显的界限,奥巴林称 之为“团聚体”,据实验回答: (1)此实验模拟的是 阶段。 (2)白明胶和阿拉伯胶模拟 。 (3)团聚体模拟 ,其特点是 。 28、年轻科学家陈火炬成功地把人的抗病毒干扰基因“嫁接”到烟草的DNA分子上,使烟草获得了抗 病毒的能力(即合成了抗病毒干扰素)。请回答: (1)人的基因之所以能接到植物体内去,原因是 。 (2)烟草有抗病毒能力,这表明烟草体内产生了 ,这个事实说明,人和植物共同有一套 ,蛋白质的合成方式 。 三、解答题:(本题共8小题,计130分) 29、(12分)有人用同位素示踪法做了一个实验,给绿色植物施用含有放射性15N的氮肥,让人吃了 这些绿色植物,最终在人尿中检测出15N,请根据15N的行程回答下列问题: (1)15N从土壤溶液中经 到达根细胞表面,又经 进入根细胞内。 (2)15N在植物体细胞内 上合成植物蛋白,该合成作用以 为模板,由 控制合成的。 (3)人食取后,在消化道内经 作用,分解成含15N的氨基酸。 (4)含15N的氨基酸由 方式进入 ,由血循环经 进入人体细胞,在细胞中经 ,被 分解成含15N部分,在 中转变成尿素,再经 等器官排出体外。 30、(14分)有机物A和B无论以何种比例混合,其组成的混合物中所含原子的核外电子总数均不变。 (1)若A是分子中含8个氢原子的烃,B是分子中含3个碳原子的烃的含氧衍生物。写出两组符合上述 要求的有机物的分子式。 ①相对分子质量之差为2:A、 B、 ②相对分子质量相等: A、 B、 (2)若A是分子中含有4个碳原子的烃,B是饱和链烃的一元含氮衍生物。则A分子式为 ,B的 分子式为 ,符合B分子式的同分异构体有 种。 31、(14分)设通电直导线中每个运动电荷的电量为q,平均定向移动速率为V,电流I与磁感强度B之 间的夹角为θ,试根据作用在整根导线上的安培力是作用在运动电荷上的力的宏观表现的思想,导出作用 在单个运动电荷上的洛仑兹力f的表达式。 32、(16分)如图所示,滑块A质量m=0.01kg,与水平地面间的动摩擦因数μ=0.2,用细线悬挂的小 球质量均为m=0.01kg,沿x轴排列,A与第1只小球相邻两小球间距离均为S=2m,线长分别为l1、l2、l3…… (图中只画出三只小球)。开始时,滑块以速度V0=10m/S沿x轴正向运动,设滑块与小球碰撞时不损失机 械能,碰撞后小球均恰能在竖直平面内完成完整的圆运动。求:
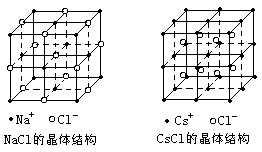
33、(16分)钢铁是最重要的金属材料。我国年产钢铁产量已超过1亿吨,居世界第一位。 (1)工业上用铁矿石和焦炭来炼铁。请写出用菱铁矿石(主要成分是FeCO3)和焦炭为原料来炼铁的 化学方程式 。 (2)从高炉冶炼得到的生铁,含铁约95%左右,要得到纯铁(含铁99.9%以上)可采用电解的方法。 电解槽的阳极材料应选用 ,阴极材料应选用 电解质溶液应采用溶液。要获取1.0kg纯铁, 电极上通过的电量理论值为 。(电子电量e=1.60×10-19C)
(1)FexO中x值(精确至0.01)为 。 (2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe3+所占分数(用小数表示精确至 0.001)为 。 (3)此晶体化学式为 。 34、(28分)材料一:酸雨是英国化学家R·A·Smith 1872年最先提出的,一般是指PH值小于5.6的 雨、雪、雾等大气降水,是大气污染的表现。酸雨被称作“空中死神”。据某市区1998年环境状况公报 载,市区酸雨频率为41.3%,比上年上升了5.5个百分点。降水年平均值为4.87,降水酸性污染较严重,表 现为煤烟型污染特征。 材料二:①某地一场较大范围的酸雨,植物叶面遭腐蚀,产生大量斑点和坏死,导致西瓜大面积绝 产,损失惨重。 ②酸雨使植物阳离子从叶面析出。使钙、镁、铁等离子迅速从土壤中损失,土壤营养状况降低。还使 光合作用抑制,影响植物生长。 ③铝对生物来说是有害元素,土壤中以氧化铝存在,PH=5.6时几乎不溶解,当PH值为4.6时,铝的溶 解度增加100倍,并转化成硫酸铝,造成树木死亡。四川某林场,华山松死亡率达96%,就是酸雨使土壤中 硫酸铝浓度增高,危及于华山松。 材料三:某校科技小组同学采集酸雨样品,每隔一段时间测定PH,得到下列数据:
请依据材料回答: (1)酸雨的形成是工业生产过程中大量矿物燃料使用,使空气中 气体较多,与降水结合产 生,请写出酸雨形成的化学反应方程式 。 (2)酸雨对高等植物的影响,表现在哪几方面? A、 , B、 , C、 。 (3)大气污染,一方面影响动、植物生长,另一方面对人类 系统危害最大,影响呼吸过程 的 ,常见疾病有 。 (4)解释酸雨放置时,PH变化的主要原因。 (5)写出PH变化的离子方程式。 (6)请根据所学的生物、化学知识,对该市的酸雨防治提出合理化建议(至少三条)。 35、(20分)铅蓄电池放电时起原电池的作用,充电时起电解池的作用,铅蓄电池在放电和充电时发 生的化学反应可用下式表示:
(1)蓄电池使用日久后正负极标志模糊,现根据下列两种条件,如何来判断正负极: ①氯化铜溶液,两根带有铜导线的碳棒 。 ②硫酸铜溶液,两根铜导线 。 (2)假如采用第②种方法进行实验,实验前后分别精确称重硫酸铜溶液和两根铜导线的总质量,假 如不考虑实验误差,前者质量将 (填“增大”、“减小”或“不变”);后者将 (填“增加”、 “减少”或“不变”)。假使两根铜导线质量之差为0.32g,则铅蓄电池内部要消耗H2SO4 mol。 (3)铅蓄电池的电压正常情况下保持2.0V,电压下降到约1.85V时需要重新充电,铅蓄电池充电时, 阴极反应式为 。 (4)现将这种铅蓄电池五节串联起来作为电源接入下图的电路中,每节蓄电池电动势为2V,内阻
36、(20分)核电站中采用核反应堆使重核裂变,将释放出的巨大能量转换成电能。 (1)完成下列核反应式:
(反中微子的质量数和电荷数均为零) (2)写出核裂变反应和一般化学反应的不同点。(请答3点) (3)核电站在热量的循环系统中应用了钠钾合金作为传热介质,试根据钠钾合金的性质说明这一应 用的两点理由。 (4)依据上述核反应方程式,计算1kg铀235全部裂变可产生多少kJ的能量?需要燃烧多少千克标准 煤才能释放出相同的能量? 已知:铀(U)核的质量为235.0439u,中子(n)质量为1.0087u,钕(Nd)核的质量为142.9098u, 锆(Zr)核的质量为89.9047u,1u=1.6606×10-27kg,燃烧1kg标准煤能产生2.93×104kJ的热量。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2000年高考理科(综合)模拟试题 参考答案及评分标准
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 一、答案及评分标准:全题90分,每小题5分,每小题全选对的得5分,不选及少选、多 选及错选均得零分。
二、答案及评分标准:全题40分,每小题4分
21、1×104(4分) 22、400(2分) 100(2分) 23、C、D、F(4分) 24、(1)六边(2分) (2)n(2分) 25、(1)C32H14(1分) (2)(Ⅰ)1(1分) (Ⅱ)4(1分) (3)不在同一平面内(1分) 26、(1)C5H9O4N(2分)
27、(4分,每空1分) (1)从有机高分子组成多分子体系 (2)蛋白质、核酸 (3)多分子体系原始界膜和原始物质交换能力 28、(4分,每空1分) (1)烟草和人的遗传物质都是DNA (2)抗病毒干扰素 遗传密码 转录和翻译 三、解答题: 29、(12分,每空1分) (1)交换吸附 主动运输 (2)核糖体 mRNA DNA (3)胃蛋白酶 胰蛋白酶 肽酶 (4)主动运输 小肠绒毛毛细血管 组织液 脱氨基 肝脏 肾脏 皮肤 30、(1)①A、C4H8 B、C3H6O ②A、C7H8 B、C3H8O3 (2)C4H10 C3H9N 4 (每空2分) 31、设导线中单位体积内含有运动电荷数为n,每个电荷的电量为q,电荷平均定向移动速 率为V,导线横截面积为S,则电流强度 I=nqSV ① (3分) 磁场对电流的安培力 F=IlBsinθ ② (2分) 式中,l为导线长度,θ为电流与磁场的夹角 设磁场作用在每个运动电荷上的洛仑兹力为f,这段导线中共有自由电荷总数 N=nlS ③ (3分) 根据安培力是洛仑兹力的宏观表现的思想 Nf=F ④ (3分) ∴ nlSf=nqSVlBsinθ f=qVBsinθ ⑤ (3分) 32、(1)设滑块与某小球碰撞前速度为V,碰撞后滑块速度为V1,小球速度为V2,滑块与 小球碰撞中不计机械能损失,所以有 mV=mV1+mV2
解得:V1=0,V2=V 即滑块与小球碰撞后速度互换。 同理,小球转一周后在最低点与滑块碰撞后速度再次互换,使滑块仍以原速度再次向前滑 行,如此多次重复,直至滑块速度减为零。(3分) 设滑块滑行的总距离为S0,有
∴ S0=25m 滑块每滑行S=2m与小球碰撞一次,设滑块共可与n只小球碰撞
即滑块可与12只小球发生碰撞。 (2)设滑块与第n(n≤12)只小球碰撞前的速度为Vn,根据动能定理
滑块与小球碰撞后,交换速度,小球在竖直平面内作圆周运动且恰能通过最高点,设小球 通过最高点的速度大小为v1',绳长ln,有
=2-0.16n(m) ⑥ (2分) 式中,n=1,2,3,…,12
(2)生铁 纯铁片 FeSO4 3.4×106C (5分) (3)0.92 (3分)
34、综合题:(18分,每小题3分)
3NO2+H2O=2HNO3+NO (2)A、抑制植物光合作用,影响植物生长。(或影响植物光合作用) B、影响植物的矿质代谢 C、有害元素毒害,导致植物死亡 (3)呼吸系统 外呼吸 咳嗽 哮喘 肺水肿(或呼吸系统疾病) (4)雨水样品中H2SO3和SO2不断被空气中氧气氧化生成强酸H2SO4,所以PH随时间延长, H+浓度增大,PH下降,至全部氧化后,溶液中形成H2SO4,不会氧化和挥发,PH值不再变化。 (5)2SO2+2H2O+O2=4H++2SO42-或2H2SO3+O2=4H++2SO42- (6)A、控制污染源(或治理污染源,达标排放) B、寻找洁净能源 C、改革工艺流程。(如烟气脱硫) D、大力开展绿化,如适当栽种柳杉 E、使用无铅汽油,逐步淘汰燃油助力车 F、微生物脱硫(源头治理) G、加强环境管理 (只要能答出其中3点即可得分) 35、(1)①先将碳棒上的铜线分别与蓄电池两极相连,然后将碳棒上有红色物质析出的 所连的为负极。 ②将铜丝与蓄电池两极相连后,插入CuSO4溶液中,经一段时间后,铜导线变粗的所连为负 极。 (2)不变 不变 0.005mol (3)PbSO4+2e=Pb+SO42-
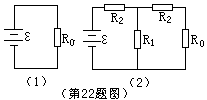
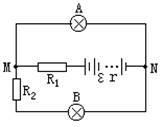
∵ B灯正常发光 ∴ IB=1(A) U并=IB(RB+R2)=1×(4+2)=6(V) (2分)
求出R1=1Ω ②因为通过A灯的实际电流为1A,所以消耗功率为PA=6W。 (2分)
(2)对单位质量的物质而言,核裂变反应的能量远远大于化学反应的能量。 核反应是原子层次上的变化,而化学反应是分子层次上的变化。(或核反应前后元素发生 变化,而化学反应前后则元素不变) 一种同位素不论处于何种价态,它们的核反应性质是相同的,而它们的化学性质是不同 的。 同一元素的不同同位素它们的化学性质是相同的,但它们的核反应性质是不同的。(6 分) (3)钠钾合金熔点低,常温下为液态,可在管道中自由流动。(4分) (4)1kg铀共释放核能
需要燃烧标准煤
|