高密高三理科综合模拟二
注意事项:
1.本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共300分,考试时间150分钟.
2.可能用到的相对原子质量量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 K 39 Ca 40 A1 27 Fe 56 Cu 64 S 32 P 31 Mg 24 Ag 108 Cr 52
第Ⅰ卷(选择题,每题6分,共126分)
一、选择题(每题只有一个选项符合题意)
1.观察肿瘤切片,下列有关其细胞的叙述中,正确的是
A.所有细胞经减数分裂增殖 B.所有细胞中都可见到染色体
C.所有细胞都能合成蛋白质 D.所有细胞中DVA含量相同
2、下列细胞或细胞结构中能合成多糖的有
①叶绿体 ②肝细胞 ③S型肺炎双球菌细胞 ④核糖体 ⑤骨骼肌 ⑥高尔基体
A.②③⑤ B.②③⑤⑥ C.①②③⑤⑥ D.①②③④⑤
3、下列关于细胞结构的说法中,正确的是
A.植物细胞的细胞壁都可以通过纤维素酶把它分解掉
B.乳酸菌、霉菌都含有核糖体和DNA
C.蓝藻在生物进化中起着重要的作用,是因为它具有叶绿体能进行光合作用
D.细胞中具双层膜结构的细胞器是叶绿体、线粒体和细胞核
4、动物细胞培养的正确过程是 ( )
A.原代培养→传代培养→细胞株→细胞系 B. 原代培养→传代培养→细胞系→细胞株
C.传代培养→细胞系→原代培养→细胞株 D. 原代培养→细胞系→传代培养→细胞株
5.下图表示在不同浓度的蔗糖溶液中,植物细胞质壁分离的百分率。结果表明植物细胞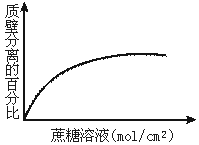
A.有不同浓度的细胞液 B.有不同厚度的细胞壁
C.有不同的体积 D.对高浓度的蔗糖溶液具有抗性
6.下列各化学式既能表示物质的化学组成,又能表示物质分子式的是
①Mg,②NH4NO3,③CH2O,④SiO2,⑤C6H5NO2,⑥Al2O3,⑦NH3·H2O,⑧P,
⑨Ag(NH3)2OH,⑩HgCl2。
A.①②⑤⑧ B.③⑤⑦⑩ C.③④⑦⑧ D.③⑤⑥⑨
7.同温同压下,下列各组热化学方程式中,△H1<△H2是
A.S(g)+O2(g)=SO2(g); △H1 S(s)+O2(g)=SO2(g); △H2
B.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.C(s)+![]() O2(g)=CO(g);△H1
C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1
C(s)+O2(g)=CO2(g);△H2
8.100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①烧瓶内气体的颜色不再加深,②N2O4 的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体的平均相对分子质量不再变化
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
9.a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
![]()
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为
下列比较中正确的是
A.原子半径:a>c>d>b B.原子的氧化性a>b>d>c
C.原子序数:a>d>b>c D.最高价含氧酸的酸性c>d>a
10.向等体积pH均为1的盐酸和醋酸溶液中分别滴加等物质的量浓度的氢氧化钠溶液,当最
后得到的两溶液pH相等时,盐酸中用去氢氧化钠溶液的体积为Vl,醋酸中用去氢氧化钠溶液的体积为V2。则Vl和V2的关系正确的是
A.Vl==V2 B.Vl>V2 C.Vl<V2 D.Vl≤V2
11..铁氧体(Fe3O4)法是处理含铬废水的常用方法。其原理是用FeSO4把废水中Cr2O72-离子还原为Cr3+离子,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物![]() ·
·![]() 。若处理含1 mol Cr2O72-的废水至少需要加入10mol
FeSO4·7H2O,则
。若处理含1 mol Cr2O72-的废水至少需要加入10mol
FeSO4·7H2O,则
A.x=1,y=4,z=6
B.x=0.5,y=1.5,z=8.5
C.x=2,y=4,z=6
D.x=2,y=6,z=4
![]() 12.二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,则下列物质的水溶液中存在的关系式正确的是
12.二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,则下列物质的水溶液中存在的关系式正确的是
A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.NaHA:c(Na+)=2c(A2-)+c(HA-)
C.Na2A: c(Na+)>c(A2-)>c(OH-)>c(H+)
D.H2A: c(H+)=c(HA-)+c(A2-)+c(OH-)
13.在铜的催化作用下氨气和氟气反应,得到一种三角锥形分子M和一种盐N。下列有关说法正确的是
A.该反应中氨气和氟气的化学计量数之比为4∶3
B.该反应的还原产物是M
C.M是极性分子,其还原性比NH3强
D.N中只有一种化学键
二、选择题(每题有一个或多个选项符合题意)
14、一定质量的理想气体,在温度不变的条件下,设法使其压强增大,则在这一过程中
A、气体的密度减小 B、气体分子的平均动能增大
C、外界对气体做了功 D、气体从外界吸收了热量
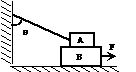 15、如图所示,质量为m的木块A叠放在质量为M的长直木板B上,A与墙壁用细绳连接,绳与墙壁间夹角为θ,A与B、B与地面间的动摩擦因数均为μ,今用一水平向右的恒力F拉B使之向右运动。关于A、B受到的摩擦力情况,下列说法中正确的是:
15、如图所示,质量为m的木块A叠放在质量为M的长直木板B上,A与墙壁用细绳连接,绳与墙壁间夹角为θ,A与B、B与地面间的动摩擦因数均为μ,今用一水平向右的恒力F拉B使之向右运动。关于A、B受到的摩擦力情况,下列说法中正确的是:
A、A受到F方向相同的摩擦力,数值为μmg
B、A受到F方向相同的摩擦力,数值小于μmg
C、B受到地面给它与F相反的摩擦力,数值一定为μ(m+M)g
D、B受到地面给它与F相反的摩擦力,数值一定等于F
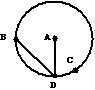 16、如图所示,将小球甲、乙、丙(均可视为质点)分别从竖直放置的圆轨道内侧A、B、C三点由静止释放,最后都到达最低点D,其中甲是从圆心A出发做自由落体运动,乙沿弦轨道从一端B(B与A等高)到D,丙沿圆轨道C点运动到D,且C点非常靠近D点。如果忽略一切阻力,则下列判断中正确的是:
16、如图所示,将小球甲、乙、丙(均可视为质点)分别从竖直放置的圆轨道内侧A、B、C三点由静止释放,最后都到达最低点D,其中甲是从圆心A出发做自由落体运动,乙沿弦轨道从一端B(B与A等高)到D,丙沿圆轨道C点运动到D,且C点非常靠近D点。如果忽略一切阻力,则下列判断中正确的是:
A、甲球最先到达D点,乙球最后到达D点
B、甲球最先到达D点,丙球最后到达D点
C、丙球最先到达D点,乙球最后到达D点
D、甲球最先到达D点,无法判断哪个球最后到达D点
17、一个以4m/s的初速度沿直线运动的物体,具有与初速度反方向,大小为2m/s2的加速度,若物体位移为3m时,所用的时间是
A、1s B、2s C、3s D、4s
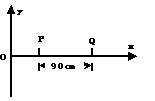 18、如图所示,在平面xoy内有一沿水平x轴正向传播的简谐横波,波速为3m/s,频率为2.5Hz,振幅为8cm。已知t=0时P质点的位移为4cm,速度沿y轴正方向,Q点在P点右方90cm处,对于Q质点来说:
18、如图所示,在平面xoy内有一沿水平x轴正向传播的简谐横波,波速为3m/s,频率为2.5Hz,振幅为8cm。已知t=0时P质点的位移为4cm,速度沿y轴正方向,Q点在P点右方90cm处,对于Q质点来说:
A、在t=0时,位移为y=-4cm
B、在t=0时,速度沿y正方向
C、在t=0.1s时,位移为y=-4cm
D、在t=0.1s时,速度沿y轴正方向
19、一对平行金属板A、B间电压变化如图所示,一个不计重力的带负电的粒子原来静止在O点,下列关于粒子的运动情况判断正确的是:
A、在t=0时,无初速的释放,粒子一定能到达B板上
 B、在t=0时,无初速的释放,粒子满足一定条件才能到达A板上
B、在t=0时,无初速的释放,粒子满足一定条件才能到达A板上
C、在t=T/4时,无初速的释放,粒子一定能到达A板上
D、在t=T/2时,无初速的释放,粒子不会到达A板上
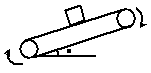 20、传送带按如图所示的方向匀速运动,将一木块轻轻的放在倾斜的传送带上,则关于木块受到的摩擦力,以下说法中正确的是:
20、传送带按如图所示的方向匀速运动,将一木块轻轻的放在倾斜的传送带上,则关于木块受到的摩擦力,以下说法中正确的是:
A、木块所受的摩擦力的方向始终沿传送带向上
B、木块所受的合力不可能为零
C、此时木块受到四个力的作用
D、木块所受到的摩擦力方向可能沿传送带向下
21、在光滑绝缘的水平面上,以O点为原点,在该水平面内建立直角坐标系Ox,假设原点O附近某一范围内存在着沿x轴方向的电场,电场E与所在位置的x坐标有关,E(x)=-αx,其中α=100V/m2。有一质量为m=3×10-4kg,电量q=2×10-6C的带正电的小球,在电场内x=4cm处由静止释放,小球在运动中电荷量保持不变,对小球的运动的如下判断中正确的是:
A、小球在x=0处的加速度为零
B、小球在x=1cm处受力的大小为2×10-6N,方向为沿x轴正方向
C、小球只能在电场中的x=-4cm到x=4cm之间运动
D、小球在x=0处电势能最大
第II卷(非选择题,共174分)
| 学科 | 物理: | 化学: | 生物: | 总分 | |||||||
| 题号 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | |
| 得分 | |||||||||||
22、实验题(本题共18分)
(1)标卡尺测得某样品的长度如图2所示,其示数L=______;用螺旋测微器测得某样品的外径如图3所示,其示数D=_______
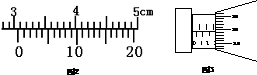
(2)所示是测定匀加速直线运动加速度的实验,打点计时器打出纸带,如果只测出了图示的数据,则上车加速度的大小是____m/s2
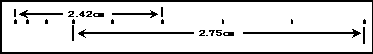
(3用金属丝制成的线材(如钢丝、钢筋)受到拉力会伸长,17世纪英国物理学家胡克发现:金属丝或金属杆在弹性限度内它的伸长的长度与拉力成正比,这就是著名的胡克定律,这一发现为后人对材料的研究奠定了重要基础。现在一根用新材料制成的金属杆,长为4m,横截面积0.8cm2,设计要求它受到拉力后的伸长的长度不超过原长的1/1000,问最大拉力多大?由于这一拉力很大,杆又较长,直接测量有困难,但可以选用同种材料制成的样品进行测试,通过测试取得数据如下:
| 长 度 |
截面积 | 250N | 500N | 750N | 1000N |
| 1m | 0.05cm2 | 0.04cm | 0.08cm | 0.12cm | 0.16cm |
| 2m | 0.05cm2 | 0.08cm | 0.16cm | 0.24cm | 0.32cm |
| 1m | 0.10cm2 | 0.02cm | 0.04cm | 0.06cm | 0.08cm |
(1)测试结果表明线材受拉力作用后伸长与材料的长度成 比,与材料的横截面积成 比。
(2)上述金属杆承受的最大拉力为 N。
23、(16分)关于中子星问题:中子星是恒星演变到最后的一种存在形式。
(1)有一密度均匀的星球,以角速度ω绕自身的几何对称轴旋转。若维持表面物质不因快速旋转而被甩掉的力只有万有引力,则该星球的密度至少多大?
(2)若有一颗中子星,它每秒转20周,以此估算这颗中子星的最小密度(引力常数G=6.67×10-11 N·m2/kg2)
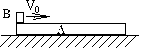 24、(18分)木板A上放着铅块B,木板平放在光滑水平桌面上,A长0.1m,B可视为质点,位于A 的左端(如图),A、B的质量均为0.05kg,A、B间的动摩擦因数μ=0.03.若铅块开始在A的最左端时有向右的速度V0=0.4m/s(对地),求:(1)铅块B在木板A上向右滑动过程中,A和B的加速度大小;(2)铅块从A的最左端运动到A的最右端所经历的时间.(g=10m/s2)
24、(18分)木板A上放着铅块B,木板平放在光滑水平桌面上,A长0.1m,B可视为质点,位于A 的左端(如图),A、B的质量均为0.05kg,A、B间的动摩擦因数μ=0.03.若铅块开始在A的最左端时有向右的速度V0=0.4m/s(对地),求:(1)铅块B在木板A上向右滑动过程中,A和B的加速度大小;(2)铅块从A的最左端运动到A的最右端所经历的时间.(g=10m/s2)
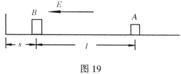 25、(20分)在绝缘水平面上放置一质量为
25、(20分)在绝缘水平面上放置一质量为![]() 的带电滑块A,带电荷量为
的带电滑块A,带电荷量为![]() 。在A的左边
。在A的左边![]() 处放置一个不带电的滑块B,质量为
处放置一个不带电的滑块B,质量为![]() ,滑块B距左边竖直绝缘墙壁s=0.05m,如图19所示。在水平面上方空间加一方向水平向左的匀强电场,电场强度为
,滑块B距左边竖直绝缘墙壁s=0.05m,如图19所示。在水平面上方空间加一方向水平向左的匀强电场,电场强度为![]() ,A将由静止开始向左滑动并与B发生碰撞,设碰撞的过程极短,碰撞后两滑块结合在一起共同运动并与墙壁相碰撞,在与墙壁发生碰撞时没有机械能损失,两滑块始终没有分开,两滑块的体积大小可忽略不计。(1)若水平面光滑,它们与墙壁碰撞后在水平面上滑行过程中,离开墙壁的最大距离为多少?(2)若水平面粗糙,设两滑块与水平面间的动摩擦因数均为μ=0.50,试通过计算分析A与B相遇前、后以及与墙壁碰撞后的受力情况和运动情况,并按照运动的先后顺序分段表述出来。(3)两滑块在上述的粗糙水平面上运动的整个过程中,由于摩擦而产生的热是多少?
,A将由静止开始向左滑动并与B发生碰撞,设碰撞的过程极短,碰撞后两滑块结合在一起共同运动并与墙壁相碰撞,在与墙壁发生碰撞时没有机械能损失,两滑块始终没有分开,两滑块的体积大小可忽略不计。(1)若水平面光滑,它们与墙壁碰撞后在水平面上滑行过程中,离开墙壁的最大距离为多少?(2)若水平面粗糙,设两滑块与水平面间的动摩擦因数均为μ=0.50,试通过计算分析A与B相遇前、后以及与墙壁碰撞后的受力情况和运动情况,并按照运动的先后顺序分段表述出来。(3)两滑块在上述的粗糙水平面上运动的整个过程中,由于摩擦而产生的热是多少?
26、(17分) I、(5分)下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计 ②容量瓶 ③滴定管 ④烧杯 ⑤圆底烧瓶 ⑥量筒 ⑦玻璃棒
(1)在仪器上具体标明使用温度的是(不考虑温度计) (填写编号);可作反应容器并可加热的是 (填写编号)
(2)需要用到温度计的实验是 (填写编号)
①用乙醇制取乙烯 ②石油分馏 ③浓硫酸稀释 ④测定硝酸钾的溶解度
(3)下列两个实验中都要用到玻璃棒,但其作用可能不完全相同
A.在“用无水碳酸钠配制100mL0.12mol/L的碳酸钠溶液”的实验中,玻璃棒的作用是: (填写编号)
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得纯净的食盐”的实验中玻璃棒的作用可能
是: (填写编号)
①搅拌 ②引流 ③蘸取溶液
II、(12分) 实验室为自然科学(化学)兴趣小组的同学准备了四种红色溶液,它们分别可能是酸性KMnO4溶液、滴有酚酞的NaOH溶液、滴有石蕊的稀硫酸、品红溶液。另外还提供了常见的必备仪器和药品。为了培养同学们的创造精神和实践能力,现规定只允许选用一种试剂对上述四种溶液加以鉴别。
(1) 甲组同学选用了FeCl2溶液,试写出该组同学鉴别出NaOH溶液的有关离子方程式:
(2)乙组同学选用了Na2SO3溶液,他们第一步鉴别出来的溶液是 ,对应的现象分别是 。
还需要继续完成的实验是:(请简要写明操作步骤、现象和结论)
步骤:
现象:
结论:
27、(12分)A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C 都只有两个电子层,B中一层电子数是另一层的两倍;C 中两层电子数之和是两层电子数之差的两倍; D中一层电子数是另两层电子数之和;E 核外各层电子数两两相等。
请按要求回答下列问题:
(1)画出E 的原子结构示意图 ,(1分)
写出由A 和C 组成的含有非极性键的化合物的电子式 。(1分)
(2)由上述元素组成的化合物中属于极性键构成的非极性分子是 。(只要求写出两种,用化学式表示)(2分)
(3)由C 与E 形成的化合物高温时与B反应生成两种化合物,请写出该反应的化学方程式 (2分)
(4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式: (2分)
(5)上述元素形成的化合物中通常能污染空气的是 (2分)(至少写出两种)。某一种可污染空气的化合物与强氧化剂单质常温下反应生成两种化合物,该反应的化学方程式为: 。(2分)
28、(24分) 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 3.钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生的气体可以在空气中燃烧 |
| 4.镁带与2mol.L-1的盐酸反应 | (D)剧烈反应,产生可燃性气体 |
| 5.铝条与2 mol.L-1的盐酸反应 | (E)生成白色胶状沉淀,既而沉淀消失 |
| 6.向AlCl3溶液滴加NaOH溶液至过量 | (F)生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的: 。(2分)
(2)实验用品:仪器:① ② ③ ④ 试管夹 ⑤ 镊子 ⑥ 小刀 ⑦ 玻璃片⑧ 砂纸等;(每空1分)
 药品:钠、镁带、铝条、2 mol.L-1的盐酸、新制的氯水、饱和的H2S溶液AlCl3溶液、NaOH溶液等。
药品:钠、镁带、铝条、2 mol.L-1的盐酸、新制的氯水、饱和的H2S溶液AlCl3溶液、NaOH溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
① ② ③ ④ ⑤ ⑥ (用A-F表示)(每空1分)
写出③的离子方程式 (2分)
(4)实验结论: (2分)
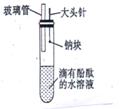
(5)有人设计了如图所示的钠与水反应实验装置,并验证钠的物理性质,钠与水反应产物。
Ⅰ.当进行适当操作时还需要的仪器有 。(2分)
Ⅱ.如何进行操作?
(4分)
Ⅲ.实验现象是
(3分)
29、(7分) A、B、C、D、E几种常见化合物或单质之间有下列转化关系
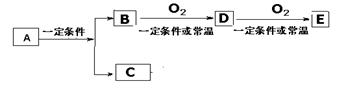
若E 是酸酐,D是有刺激性气味的气体,则B 的化学式是 。工业上实现 D 转化为E 的化工设备的名称 。
若C 是酸性气体,B 是碱性气体,则E是 ,工业生产中,合成B选择一定的下列条件的依据是:①压强 ② 温度
除上述以外,符合上述转化条件的,请写出两种符合下列要求A物质的化学式A为有机物 A为无机物
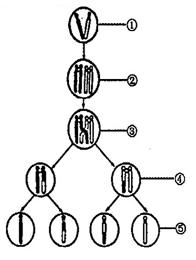 30(一)根据右图回答:
30(一)根据右图回答:
(1)表示初级精(卵)母细胞的是 号图。
(2)图中①、②、③、④分别含有 个染色体。
(3)含同源染色体的是 号图,它含有
对同源染色体。
(4)②号图含 条染色单体。
(5)该细胞分裂有哪些特点?⑴
⑵
⑶ (6)请画出减数分裂过程中染色体和DNA数目变化的曲线图
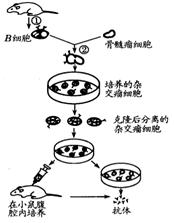
(二)右图为某同学根据杂交瘤技术的方法,设计的生产破伤风杆菌抗体的实验方案。据图回答:
(1)该方案能达到预期效果吗? 。原因是 。
(2)图中②为 过程,常用 作为诱导剂。单克隆抗体最终要从
和
提取。
(3)干扰素能够阻止禽流感病毒的增殖,如果要用此方法生产干扰素,则与骨髓瘤细胞融合的细胞是从禽流感患者体内的血液中分离得到的
,培养杂交瘤细胞的培养液的成分是
(4)生产抗SARS病毒的抗体,还可采用基因工程的方法,提取目的基因常用的方法是 。
(7)如果科学家运用基因工程的方法用羊产生抗体,目的基因的受体细胞以 为宜,合成分泌抗体的细胞以 为宜,垂体分泌的 可以促进抗体分泌。
31.以下是两个用玉米胚芽鞘作为实验材料,研究生长素对植物生长影响的实验。
实验1:将切下的胚芽鞘尖端放置于琼脂块上(图1),移去尖端后,将琼脂切成体积相同的若干方块,将方块以一种特殊的方式放在除去尖端的胚芽鞘上,置于黑暗处12小时,每个胚芽鞘弯曲的角度以图2的方式测量。每次放入相等面积、相等体积琼脂块中的胚芽鞘尖端的数量不同,重复上述实验过程。实验结果见图3。
实验2:用含有不同浓度生长素的琼脂块取代胚芽鞘尖端进一步实验,实验结果见图4。
 (1)要得到图2的结果,琼脂块
(1)要得到图2的结果,琼脂块
必须以 方式放
在胚芽鞘上(用图表示)。
(2)实验强调在黑暗中进行,原因是
。
(3)解释实验2的结果 。
(4)根据图示实验结果,两种实验条件下的最大弯曲度分别
是 _ 、 。比较实验1和实验2
结果,不同点是
。
6-B 7-A 8-A 9-D 10-C 11-D 12-C 13-A
26、I(1)②③⑥;④⑤ (2)①②④ (3)①②;①②③(每空2分,整体给分
II答案:(1). Fe2+ + 2OH- =Fe(OH)2↓ 4Fe(OH)2+ O2 +2H2O=4Fe(OH)3
(2). 酸性高锰酸钾溶液和稀硫酸;褪色和产生有刺激性气味的气体。另取未鉴别出来的两种待测液各少量,分别滴加稀硫酸,红色褪去者为氢氧化钠溶液,剩余为品红溶液。
27、答案:(1)![]() (2) CH4、CO2
、CS2
(2) CH4、CO2
、CS2
![]() (3)CaO+3C
CaC2+CO↑ (4)Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓
(3)CaO+3C
CaC2+CO↑ (4)Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓
(5) CO、SO2、H2S 等 H2S +O3 = SO2+H2O
28、答案:(1) 探究同周期元素的金属性和非金属性的递变规律。
(2) 试管 ; 酒精灯; 胶头滴管 (3)① B ② F ③ A ④ D ⑤ C ⑥ E
2Na+2H2O=2Na++2OH-+H2↑
(4)金属性:Na > Mg > Al 非金属性:Cl > S
(5)Ⅰ.小试管和酒精灯 Ⅱ.将大头针向上提,使钠块落入水中,将小试管扣在玻璃导管上收集反应产生的气体,用拇指堵住试管口,移至酒精灯上方,点燃。 Ⅲ. 钠浮在水面上熔成闪亮的小球,迅速游动,有响声、逐渐消失,水溶液由无色变成红色。
29、答案:(1) S、 接触室(2) NO2、① 动力、材料、设备等条件 ② 催化剂的活性温度(3)、 CH3CH2OH 、NaCl
 拉力
拉力