初中毕业班化学综合测试题
化学试卷
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Ca 40
第一卷(选择题,共40分)
一、选择题
注意:每道选择题有四个选项,其中只有一项符合题意。请用铅笔在答题卡上作答。选错、不选、多选或涂改不清的,均不给分。
1.对下列物质中属于氧化物的是
A. NaOH B. Na2O C. NaNO3 D. Na2SO4
![]() 2.雷雨过后,空气特别清新,这是因为少量氧气在一定条件下能转化成臭氧(O3),反应方程式为3O2 2O3 下列说法中正确的是:
2.雷雨过后,空气特别清新,这是因为少量氧气在一定条件下能转化成臭氧(O3),反应方程式为3O2 2O3 下列说法中正确的是:
① 该变化属于物理变化, ②该变化属于化学变化,
③O2与O3是同一种单质, ④O2和O3是同一种元素组成的不同单质,
⑤O3是混合物,
A.②③ B.①④ C.①⑤ D.②④
3.下列原子属于金属元素的是
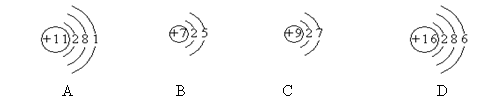
4.随着“神舟六号”的发射成功,我国还将发射绕月探测卫星。其任务之一是寻找一种新能源——氦。 氦的原子核是由1个中子和2个质子构成的,其原子核外的电子总数为
A.1 B.2 C.3 D.4
5、借用分子的相关知识解释下列现象或事实,,其中不正确的是
A.热胀冷缩,说明分子大小随温度改变而改变
B.酒香不怕巷子深,说明分子不断地运动
C.25m3的氧气可以装入0.024m3的钢瓶中,说明分子之间有间隙
D.水通电后生成氢气和氧气,说明在化学变化中分子可以再分
6、化学反应前后肯定没有变化的是
①原子数目 ②分子数目 ③元素种类 ④物质种类
⑤原子种类 ⑥物质的总质量
A、①④⑥ B、①③⑤⑥ C、①②⑥ D、②③⑤
7、下列各组含氯物质中,氯元素化合价不相同的一组是
A、Cl2 HCl B、NaClO HClO
C、HClO2 NaClO2 D、KClO3 Ca(ClO3)2
8、尿素CO(NH2)2是人尿中的一种物质,尿素中元素的质量分数最小的是
A.H B. O C.C D. N
9、下列反应属于分解反应的是
A、镁与盐酸反应制得氢气
B、木炭与氧化铜混合加热得到金属铜
C、煅烧碳酸钙固体得到氧化钙
D、蜡烛在氧气中燃烧得到二氧化碳
10、下列溶液中pH大于7的是
A、盐酸 B、氢氧化钠溶液
C、食用醋 D、稀硫酸
11、下列说法不正确的是
A、化学反应在生成新物质的同时,可能伴随着能量的变化
B、“可燃冰”其中主要含有甲烷水合物,可能成为未来的新能源
C、几干万年前地球上一条恐龙体内的某个原子可能在你的身体里
D、塑料、合成纤维和合成橡胶等是重要的有机合成材料,使用有机合成材料会对环境造成影响
12、酸雨的出现,是因为空气中增加了大量的
A、二氧化碳 B、一氧化碳 C、二氧化硫 D、盐酸
13、某同学做物质在氧气中燃烧的操作如下图所示,其中不合理的是
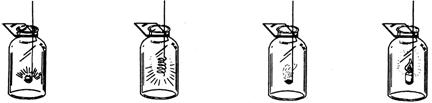
| A B C D 木炭在氧气中燃烧 铁丝在氧气中燃烧 硫在氧气中燃烧 蜡烛在氧气中燃烧 |
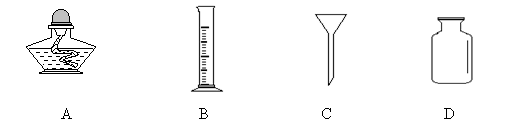
14、取20ml稀盐酸,需要用到的仪器是
15、下列对实验现象的叙述中,正确的是
A.往稀盐酸中滴入硝酸银溶液,产生白色沉淀
B.红磷在空气中燃烧,产生浓厚的红烟
C.向硫酸铜溶液中滴加氢氧化钠溶液,出现蓝色沉淀,再加稀硝酸沉淀不溶解
D.将一氧化碳通过灼热的氧化铜,固体颜色由黑色变为红色,放置于空气中冷却,红色仍然保留。
16、某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序设计了四种方案,每种方案所需试剂如下,你认为不可行的是
A.Fe、Ag、CuSO4溶液
B.Cu、Ag、FeSO4溶液
C.Fe、Cu、稀盐酸、AgNO3溶液
D.Cu、FeCl2溶液、AgNO3溶液
17、试管内壁附着的下列物质不能用稀盐酸浸泡而除去的是
A、盛石灰水后留下的白色固体
B、氯化铁溶液与氢氧化钠溶液反应后留下的红褐色固体
C、用一氧化碳还原氧化铁留下的黑色物质
D、用足量的一氧化碳还原氧化铜留下的红色物质
18、往三种物质组成的混合物中加人足量的水,搅拌,发现有难溶于水的物质存在,再加人过量的稀硝酸,仅有部分沉淀溶解。此混合物的组成可能是
①KCl、Mg(OH)2、AgNO3 ②Na2CO3、CaCl2、BaCl2
③NaOH、MgSO4、Ba(NO3)2 ④NaNO3、MgCl2、AgNO3
A.①② B.①③ C.②③ D.②④
19、某学生有以下的认为,其中不合理的是
A.盛放烧碱溶液的试剂瓶敞口放置,烧碱会变质
B.用稀硫酸可以把氯化钡溶液、碳酸钠溶液和氢氧化钠溶液鉴别开来
C.要除去氯化钠溶液中混有的少量硫酸铜,可以向溶液中加入氢氧化钡溶液 D.可以按溶解、过滤、蒸发的顺序分离氧化钙和CaCO3
20、将50g20%的硝酸钾溶液稀释到200g,稀释后所得溶液中溶质的质量分数是
A.20% B.10% C.5% D.1%
第二卷(非选择题,共60分)
二、本题包括5小题,共34分。
21、(7分)用化学用语表示下列物质或反应:
(1)硝酸铜 ;
(2)2个硫原子 ; 6个硫原子构成的硫磺分子 ;
(3)人体的胃酸通常是盐酸,在医疗上,治疗胃酸过多症的药剂中通常含有碳酸氢钠,反应的化学方程式是 ;
(4)氯化钠和氯化镁的混合溶液中,存在的微小粒子是 。
22、(5分)下图是a、b、C三种固体物质的溶解度曲线。
![]()
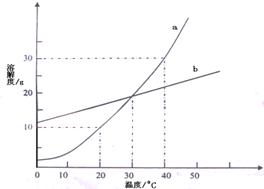
(1) 根据图中C物质的溶解度曲线说明,C物质的溶解度的变化趋势是 ;
(2) 配制浓的C溶液比配制稀的C溶液,选择的温度要 (填:高或低)。
(3)20℃时,50g水中最多能溶解的a物质的质量是 g,所得溶液的质量是 g。
23、(9分)在牙膏和一些药品中常用优质碳酸钙粉末作填充剂或载体。而优质碳酸钙粉末的制作通常是按下列程序:
先将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰水,然后将净化后的石灰水与二氧化碳作用得到碳酸钙。(注:石灰石在煅烧时受高温分解,除了产生氧化钙,还产生了一种可以产生温室效应的气体物质)
(1) 试用化学方程式表示上述反应的原理
(2)计算:
① 碳酸钙(CaCO3)的相对分子质量是
② 200t含碳酸钙70%的石灰石中,碳酸钙的质量是
③ 往50g、7.4%的澄清的石灰水里通入二氧化碳。至少通入了 g的二氧化碳,才能将其中的氢氧化钙全部转化为碳酸钙。
24、(6分)生活中我们常常会遇到一些棘手的事情,需要用科学方法处理。如:
(1)蚊子、蜂、蚂蚁等昆虫叮咬人后,会向人体注入一种物质R,使皮肤红肿疼痛。为了测定R物质的性质,有同学首先向盛有氢氧化钠溶液的锥形瓶里滴入酚酞溶液,溶液变成 色,然后继续往锥形瓶中逐滴加入R溶液并振荡,当加到一定量时溶液的颜色全部褪去。由此可以推断,R是一种 性的物质,要消除肿痛,可涂抹下列物质中的 。
A.食用醋 B.食用油
C.稀氨水或肥皂水 D.氢氧化钠溶液
E. 稀的石灰水溶液
(2)家用热水壶(铝制)长时间使用后内壁会有一层水垢,主要成分是Mg(OH)2和CaCO3。用盐酸可以除去水垢操作时,一定要注意好盐酸的用量和操作方法,否则水壶会穿孔。说明穿孔的原理,写出有关反应的化学方程式
25、(7分)下面是分离硝酸钾和硝酸钙混合液的示意图:
| |||
| |||
|
![]() 入一 ① ① ①加入一种
入一 ① ① ①加入一种
![]() P
过 过量盐溶液
P
过 过量盐溶液
|
|
![]()
![]()
![]() ③加适量HNO3
蒸发 硝酸钾
③加适量HNO3
蒸发 硝酸钾
回答下列问题:
(1) 加入的盐是
(2) 写出①、②所起反应的化学方程式。
(3) 滤液中加入适量HNO3的原因
(3) 在溶液蒸发获得晶体时,防止晶体损失的操作是
三、本题包括4小题,共26分。
26、(6分)用下列盛有药品的仪器(图中夹持仪器等均省略),做下列实验
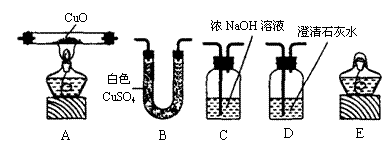
① 证明或除去混合气体中可能含有的二氧化碳、一氧化碳和水蒸气。
若检验其中是否含有二氧化碳,应选用(填序号) ,
若除去二氧化碳,应选用(填序号) ,
若证明含有水蒸气,则B中的现象是 ;
若A中玻璃管内物质由黑色变成红色,则混合气体中含有 。
②用上述仪器组装一套装置,通过一次实验同时检验上述气体中是否含有二氧化碳、一氧化碳和水蒸气。按气体通过的先后顺序连接仪器依次是(填序号,仪器可以重复使用) 。
27.(6分)中和反应在日常生活和工农业生产中有广泛应用。如:
(1)农业上可用来降低土壤的酸性,改良土壤结构的物质是 。
(2)医疗上可用含氢氧化镁的药物来中和过多的胃酸(视为盐酸),有关反应的化学方程式为 。
(3)如何检验某硫酸厂排出的废水是否具有酸性?请设计出两种实验方案(写出简要的实验步骤、现象及结论)。
方案一: ;
方案二: 。
(4)取某硫酸厂排出的一定体积的废水与一定量的氢氧化钠溶液混合后,溶液恰好呈中性。若改用与该氢氧化钠溶液的质量和溶质质量分数均相同的氢氧化钾溶液与上述一定体积的废水混合,则所得溶液的pH_____7(填“>”、“<”或“=”)。
28、(6分) “用双氧水和二氧化锰制氧气”的反应方程式为 。某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究。他们进行了以下实验:
| 编号 | 实验 | 现象 |
| ① | 往盛有5 mL 5 % H2O2溶液的试管中,伸入带火星的木条, | 木条不复燃 |
| ② | 往盛有5 mL 5 % H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条, | 木条复燃 |
问题:
(1) 设计实验①的目的是 。
(2) 如果要证明MnO2是否是上述反应的催化剂,还需要检验___________。
研究小组还展开了催化剂MnO2的用量对反应速率有没有影响的思考与探究:
他做了这样一组实验:每次均用30 mL 10%的H2O2溶液,采用不同量MnO2粉末作催化剂,测定各次收集到500 mL氧气时所用的时间,结果如下(其他实验条件均相同):
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2粉末用量(g) | O.1 | 0.2 | 0.3 | 0.4 | 0.5 | O.6 | 0.7 | 0.8 | O.9 | 1.O |
| 所用时间(s) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
问题:
(4)请分析表中数据回答:MnO2的用量对反应速率有没有影响?如果有,是怎样影响的呢?答: 。
29、(6分)实验室有三瓶没有标签的固体,分别是CuO、CaO、CaCO3,只用一种生活中每天必需用到的物质,设计一个实验方案进行鉴别,并完成实验报告。
| 实验步骤 | 实验现象与结论 |
| 1、 | |
| 2、 |
初中毕业班综合测试
化学试卷
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Ca 40
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | D | A | B | A | B | A | A | C | B | A | C | B | B | A | B | D | B | D | C |
二、本题包括5小题,共34分。
21.(1)Cu(NO3)2 (1分)
(2)2S,S6 (各1分,共2分)
(3)HCl+NaHCO3====NaCl+H2O+CO2↑(2分)
(4)Na+、 Mg2+、 Cl-、H2O (2分)
22.(1)随着温度的升高,C物质的溶解度降低。(2分)
(2)低 (2分) (3)5,(2分)
高温
23.(1)CaCO3==== CaO+CO2↑
CaO+H2O==== Ca(OH)2
Ca(OH)2+CO2===== CaCO3↓+H2O
(2) ①100 ②140t ③3.7, 2.2
24.(1)红、 酸性、 C
(2)过量的盐酸可与铝反应,使铝器溶解,
Mg(OH)2+2HCl====MgCl2+H2O
CaCO3+2HCl====CaCl2+H2O+CO2↑
2Al+6HCl====2AlCl3+3H2↑ (各1分,共6分)
25.(1)Na2CO3 (1分)
(2)Ca(NO3)2+Na2CO3==== CaCO3↓ + 2NaNO3 (2分)
CaCO3+2HNO3==== Ca(NO3)2 + H2O+CO2↑(2分)
(3)除去过量的Na2CO3 (1分)
(4)当溶液中溶剂被蒸发至产生较多晶体后,停止加热,并继续搅拌至晶体冷却。 (1分)
三、本题包括4小题,共26分。
26.① D ,C 白色晶体变蓝,CO ② B、 D、C、A、D、E
27. (方程式2分,其他每空1分)
(1)Ca(OH)2
(2)Mg(OH)2+2HCl =====MgCl2 +2H2O
(3)方案一:取少量该溶液置于试管中,向其中滴加几滴紫色石蕊试液,若变红,则证明废水具有酸性。
方案二:取少量该溶液置于试管中,向其中滴加几滴Na2CO3 溶液,若有气泡产生,则证明废水具有酸性。
(4)pH<7
MnO2
28.2H2O2====2H2O+O2↑
(1) 观察常温下双氧水能否分解出氧产生氧气,以便于MnO2对水的作用的比较
(2) 反应后MnO2的质量
(3) MnO2的用量对反应速率有影响。在一定的用量范围内,MnO2用量的增加,反应所需的时间减少,反应速率增大,当MnO2的用量增加到一定的值后,继续增大MnO2的用量,反应速率不再增大。
29.(6分)
| 实验步骤 | 实验现象与结论 |
| 1、观察固体物质的颜色(1分) | 黑色的固体物质是CuO,(1分) 白色的固体物质是CaO和CaCO3。(1分) |
| 2、将两种白色固体物质分别取少许装入试管,并往其中加入水少许,摇动试管, 用手触摸试管。(1分) | 用手触摸试管,有发热(1分)的试管中盛装的固体是CaO,无发热的是CaCO3。 CaO + H2O ====== Ca(OH)2 + 热(1分) |