《酸、碱、盐》知识点归纳
2006.3.30
一、酸
1. 酸的5条通性
①酸和各种指示剂和pH试纸反应
| 酸的名称 | 石蕊试液 | 红色石 蕊试纸 | 蓝色石 蕊试纸 | 酚酞试液 | 白色酚 酞试纸 | pH试纸 |
| 盐酸 | ||||||
| 稀硫酸 | ||||||
| 浓硫酸 | ||||||
| *硝酸 | ||||||
| 碳酸 |
【浓硫酸具有脱水性(化学性质),所以试纸变成黑色】
②酸+活泼金属→盐+氢气
(注意:活泼金属是指金属活动性大于氢;酸是指盐酸或者稀硫酸)
例如:请写出金属镁带、锌粒和铁钉和盐酸反应的化学方程式,并且分析为什么实验室一般选用锌粒和盐酸或者稀硫酸反应来制取氢气?
反应方程式:镁带和稀硫酸
锌粒和盐酸
铁钉和盐酸
为什么实验室一般用锌粒,而不用铁或者是镁来制取氢气?
③酸+碱→盐+水
(注意:本反应是复分解反应【基本反应类型】,且是中和反应【属于复分解反应】)
| 举例 | 有关的化学方程式 | 简答 |
| 在烧碱溶液中滴加盐酸溶液 | 反应的基本类型: | |
| 在石灰水中滴加过量的硫酸溶液 | 如果在石灰水中预先滴加石蕊试液,可以看到颜色的变化是:
| |
| *在氢氧化铜中滴加硝酸溶液 | 可以看到的实验现象是:
| |
| *在氢氧化铁中滴加硝酸溶液 | 可以看到的实验现象是:
|
④酸+盐→新盐+新酸
| 举例 | 有关的化学方程式 | 简答 |
| 实验室制 取二氧化碳 | 反应的基本类型: | |
| 用氯化钡检验盐酸溶液和硫酸溶液 | 实验现象是:
| |
| 在硝酸银溶液中滴加盐酸 | 可以看到的实验现象是有白色沉淀,在滴加 沉淀不消失 | |
| 在碳酸钠溶液中滴加盐酸溶液 | 可以看到的实验现象是:
| |
| 在碳酸钡溶液中滴加硫酸溶液 | 可以看到的实验现象是:
|
⑤酸+碱性氧化物→盐+水
| 举例 | 有关的化学方程式 | 简答 |
| 用浓盐酸来 去除铁锈 | 实验现象: | |
| 用硫酸去 除氧化铁 | 反应前后铁元素的化合价 (变/不变) | |
| 在黑色氧化铜粉末中滴加硫酸 | 实验现象是 |
2.其他
①物理性质
| 名称 | 颜色 | ▲导电性 | 状态 | 挥发性 | ▲密度 | 吸水性 |
| 浓盐酸 | 无色 工业盐酸:黄 | 导电 | 液态 | 有 | 比水的密度大 | 无 |
| 硫酸 | 无色 | 无 | 浓硫酸:有 稀硫酸:无 | |||
| 浓硝酸 | 有 | 无 |
【浓硫酸具有吸水性所以可以作为许多气体干燥剂,但是浓硫酸不能干燥氨气】
②用途
| 物质 | 用途 |
| 盐酸 | 制药、去除铁锈、制染料、味精、葡萄糖等 |
| 硫酸 | 去除铁锈、制化肥、农药和炸弹等 |
二、碱
1.碱的4条通性
①酸和各种指示剂和pH试纸反应
| 碱的名称 | 石蕊试液 | 红色石 蕊试纸 | 蓝色石 蕊试纸 | 酚酞试液 | ▲白色酚 酞试纸 | pH试纸 |
| 氢氧化钠 | ||||||
| 氢氧化钙 | ||||||
| *氢氧化钾 |
②酸+碱→盐+水
(注意:本反应是复分解反应【基本反应类型】,且是中和反应【属于复分解反应】)
| 举例 | 有关的化学方程式 | 简答 |
| 在火碱溶液中滴加硫酸溶液 | 反应的基本类型: | |
| 在石灰水中滴加过量的盐酸溶液 | 如果在此石灰水中预先滴加酚酞试液,反应后,可以看到颜色的变化是: | |
| 在氢氧化铜中滴加硫酸溶液 | 可以看到的实验现象是:
| |
| *在氢氧化镁中滴加硝酸溶液 | 可以看到的实验现象是:
|
③碱+盐→新盐+新碱
| 举例 | 有关的化学方程式 | 简答 |
| 苏打溶液和石灰水反应 | 反应前后,溶液的pH值 (变大、变小、不变) | |
| 碳酸钾溶液和氢氧化钡溶液反应 | 在生成的白色沉淀中,再滴加硫酸溶液,可以看到 | |
| *硫酸铜溶液和氢氧化钾溶液反应 | 硫酸铜溶液是 色的。反应后,可以看到 | |
| 氯化铁溶液中滴加氢氧化钠溶液 | 实验现象是: | |
| *氯化镁溶液中滴加氢氧化钾溶液 | 在生成的白色沉淀中,再滴加硫酸溶液,可以看到 |
④碱+酸性氧化物→盐+水
| 举例 | 有关的化学方程式 | 简答 |
| 实验室用石灰水检验二氧化碳 | 实验现象是: | |
| 实验室用苛性钠吸收二氧化碳 | 反应后,得到的盐溶液的pH (<7/ =7/ <7) | |
| 工业上常用氢氧化钠吸收二氧化硫 | 二氧化硫是一种引起 的物质 |
2.其他
①物理性质
| 名称 | 颜色 | 潮解 | ▲导电性 | 密度 |
| 氢氧化钠 | 固体:白色 溶液:无色 | 固体:有 溶液:没有 | 导电 | 比水的密度大 |
| 氢氧化钙 | 无 | |||
| *氢氧化钾 |
【氢氧化钠能够潮解,所以可以作为许多气体干燥剂,但是它不能干燥酸性的气体,如:氯化氢、二氧化碳、二氧化硫、氯气等】
②用途
| 物质 | 用途 |
| 氢氧化钠 | 制皂、炼铝、造纸、精炼石油等 |
| 氢氧化钙 | 建筑、改良酸性土壤、配制波尔多液、制造漂粉精等 |
三、几种重要的盐
| 物质 | 俗称 | 物理性质 | 化学性质 | ||
| 固体颜色 | 溶液颜色 | 溶解性 | |||
| 氯化钠NaCl | 食盐 | 白 | 无 | 可溶 | ①氯化钠可以和硝酸银反应 NaCl+AgNO3→AgCl↓+Na NO3 ②电解饱和氯化钠溶液可以得到氢氧化钠、氢气和氯气 |
| 碳酸钠 Na2CO3 | 苏打、纯碱 | ① 石碱会风化 ② 碳酸钠溶液是碱性的,pH>7 ③ 碳酸钠可以和酸反应 2HCl+ Na2CO3→2NaCl+ H2O +CO2↑ ④ 碳酸钠可以和石灰水(碱)反应 Na2CO3+Ca(OH)2→CaCO3↓+2NaOH ⑤ 碳酸钠可以和氯化钙(盐)反应 Na2CO3+CaCl2→CaCO3↓+2NaCl | |||
| 碳酸钠晶体 Na2CO3•10H2O | 石碱、纯碱晶体 | ||||
| 硫酸铜 CuSO4 | 无水硫酸铜 | 蓝 | ① 无水硫酸铜检验水的存在 CuSO4+5H2O→CuSO4•5H2O (实验现象: ) ②
CuSO4•5H2O→CuSO4+5H2O (反应基本类型: ) ③ 硫酸铜和铁(活泼金属)反应 Fe+ CuSO4→Cu+ Fe SO4 (可用于去除硫酸亚铁中含有少量的硫酸铜) ④ 硫酸铜和碱反应 CuSO4+ Ba (OH)2→Ba SO4↓+Cu(OH)2 (此化学方程式可用于除去硫酸铜) CuSO4+2NaOH→Cu(OH)2↓+Na2 SO4 ⑤ 硫酸铜和氯化钡(盐)反应 CuSO4+BaCl2→Ba SO4↓+Cu Cl2 | ||
| 硫酸铜晶体 CuSO4•5H2O | 胆矾、蓝矾 | 蓝 | |||
【注意:氯化钠的溶解度受温度影响不大,因此要得到氯化钠晶体,可以采用蒸发结晶的方法;硝酸钾的等物质的溶解度受温度影响比较大,因此可以采取冷却热饱和溶液的方法】
▲ 知识整理
1、 物质的颜色
| 物质 | 颜色 | 物质 | 颜色 | 物质 | 颜色 |
| 硫酸铜溶液 | 蓝 | 氯化铜溶液 | 蓝 | 硝酸铜溶液 | 蓝 |
| 硫酸铁溶液 | 黄 | 氯化铁溶液 | 黄 | 硝酸铁溶液 | 黄 |
| ▲硫酸亚铁溶液 | 浅绿 | 氧化镁 | 白 | 四氧化三铁 | 黑 |
| 氧化铁 | 红 | 氧化铜 | 黑 | 二氧化锰 | 黑 |
| 氢氧化铁 | 红褐 | 氢氧化铜 | 蓝 | 氢氧化镁 | 白 |
| 硫酸铜粉末 | 白 | 硫磺 | 黄 | 红磷 | 红 |
2、物质在空气中长期露置,请判断可能发生的变化(变大、不变、变小)
| 物质 | 质量 | ▲溶液密度 | 变化 | 溶液浓度 | 原因 |
| 浓盐酸 | 变小 | 变小 | 物理变化 | 变小 | 盐酸具有挥发性,挥发出氯化氢气体 |
| 浓硫酸 | 变大 | 变小 | 变小 | 浓硫酸具有吸水性 | |
| 氢氧化钠(固体) | 变大 | / | 化学变化 | / | ① 固体氢氧化钠能够潮解,所以其表面会“出汗” ② 固体氢氧化钠还会和空气中的二氧化碳反应 |
| 生石灰 | 变大 | / | / | ①生石灰会和空气中的水反应,生成熟石灰 ②熟石灰会继续和二氧化碳反应 | |
| 石灰水 | 溶液质量变小 | 变小 | 变小 | 石灰水会和二氧化碳反应 | |
| 石碱 | 变小 | / | / | 石碱会风化 | |
| 无水硫酸铜 | 变大 | / | / | 无水硫酸铜会吸收空气中的水(颜色由白色变成蓝色) |
3、 检验气体
检验气体
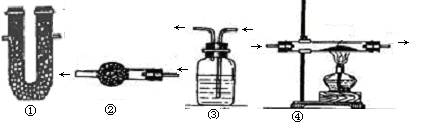
仪器名称:①U型管②干燥管③洗气瓶(“多功能瓶”)④硬质玻璃管
| 物质 | 选用试剂和装置 | 化学方程式 |
| 水蒸汽 | ①或者②中放无水硫酸铜 | |
| 氢气 | ④中放氧化铜+ ①或者②中放无水硫酸铜 | |
| 二氧化碳 | ③中石灰水 | |
| 一氧化碳 | ④中放氧化铜+③中石灰水 | |
| 氯化氢气体 | ③中硝酸银溶液 |
4、去除杂质(气体)

仪器名称:①U型管②干燥管③洗气瓶(“多功能瓶”)④硬质玻璃管
| 物质 | 选用试剂和装置 | 化学方程式 |
| 氧气 | ④中放铜粉或者用铜网 | |
| 水蒸汽 | ①或者②中放固体氢氧化钠或碱石灰或者③中浓硫酸(最常用) | |
| 氢气 | ④中放氧化铜 | |
| 二氧化碳 | ①或者②中放固体氢氧化钠或碱石灰//③中氢氧化钠溶液 | |
| 一氧化碳 | ④中放氧化铜 |
5、检验物质
| 被检验物质 | 选用的试剂 | 现象 | 有关的化学方程式 |
| 碳酸盐 | ①酸 | 气泡 | 例如:2HCl+ Na2CO3→2NaCl+ H2O +CO2↑ |
| ②氢氧化钙或氢氧化钡 | 白色沉淀 | 例如:Na2CO3+Ba(OH)2→BaCO3↓+2NaOH K2CO3+Ca(OH)2→CaCO3↓+2KOH | |
| ③可溶性的钡盐或者钙盐 | 例如:Na2CO3+BaCl2→BaCO3↓+2NaCl Na2CO3+CaCl2→CaCO3↓+2NaCl | ||
| 硫酸盐 | 钡盐 (再滴加稀酸) | 白色沉淀 (不消失) | 例如:Na2SO4+BaCl2→BaSO4↓+2NaCl |
| 盐酸盐 | 硝酸银 (再滴加稀酸) | 白色沉淀 (不消失) | 例如:AgNO3+NaCl→NaNO3+AgCl↓ |
| ▲铵盐 | 可溶性碱 | 刺激性 气味 | 例如:NH4Cl+NaOH→NaCl+NH3↑+ H2O |
6、物质的溶解性
①可溶性碱:氢氧化钾、氢氧化钙、氢氧化钠、氢氧化钡、▲氨水
②可溶性盐:钾盐、钠盐、铵盐、硝酸盐、硫酸盐(除硫酸钡)、盐酸盐(除氯化银)
(技巧:后三个正好对应的酸是三大强酸、前3个对应的碱也是溶于水的)
7、有关物质的酸碱性
一般而言,酸溶液是酸性的(pH<7);大多数的盐溶液是中性的(pH=7);碱溶液是碱性的(pH>7)。
【但是,在初中阶段学生还必须掌握①碳酸钠溶液②草木灰(主要成分是碳酸钾)的水溶液是碱性的(pH>7,能够使酚酞试液变红色,使紫色石蕊试液变蓝色)。】
8、化肥
①能够被植物所吸收的营养元素(比如:N、P、K等)主要是以化合态存在于盐中或者有机物中
②尿素是含氮量最高的氮肥
|
④碳铵的施用:不能在受热受潮下使用,原因是NH4HCO3→NH3↑+H2O+CO2↑(氮元素流失)
9、几种物质的俗称
| 物质 | 化学式 | 俗称 | 物质 | 化学式 | 俗称 |
| 氯化钠 | NaCl | 食盐 | 碳酸钠 | Na2CO3 | 苏打、纯碱 |
| 氢氯酸 | HCl | 盐酸 | 碳酸钠晶体 | Na2CO3•10H2O | 纯碱晶体、石碱 |
| 氢氧化钠 | NaOH | 火碱、烧碱、苛性钠 | 硫酸铜 | CuSO4 | 无水硫酸铜 |
| 氢氧化钙 | Ca(OH)2 | 固体:熟石灰、消石灰 溶液:石灰水 | 硫酸铜晶体 | CuSO4•5H2O | 胆矾、蓝矾 |