中考化学模拟考试题一
(第一卷 选择题)
可能要用的相对原子质量:H:1,C:12,O:16,Na:23,Mg:24,Al:27,Cl:35.5,Fe:56,Cu:64,
一、单项选择(每题只有一个选项符合题意)
1.成语是中华民族语言的瑰宝,下列与水有关的成语中,涉及到化学变化的是
A. 水乳交融 B. 水落石出 C. 滴水穿石 D.滴水成冰
2、易拉饮料罐是用很薄的铝片制成的,在空罐中注入少量水,用酒精灯加热到沸腾,待大量水蒸气逸出后,先移去酒精灯,再用厚胶纸把罐口封住,待自然冷却后,会发生的现象是
(A)罐外壁出现小水滴 (B)罐变瘪了
(C)罐爆裂了 (D)罐变瘪了,且罐外壁出现小水滴
3、用Mg、MgO、Mg(OH)2、H2SO4溶液、CuSO4溶液五种物质两两进行反应,能得到MgSO4的方法有
A,三种 B,四种 C,五种 D,无法确定
4、在A、B、C、D四种物质的溶液中含有Na+、Fe3+、Ag+、Cu2+、SO42-、Cl-、OH-、 NO3-等八种离子,现将这四种物质的稀溶液两两混合,有如下现象产生 :
⑴ A+B →蓝色沉淀 ⑵ D+C→白色沉淀(此沉淀不溶于稀硝酸)
⑶ B+D →红褐色沉淀 根据上述现象,推断并写出各物质的化学式,结论正确的是
A、A一定为NaOH B、B可能为CuSO4
C、C只能为AgNO3 D、D可以为FeCl2
5、在化学反应中铁原子容易失去2个或3个电子,因此铁元素在化合物中常显+2价或+3价。化合物Fe3O4 又写作Fe(FeO2)2,在化合物Fe(FeO2)2中,括号前和括号内铁元素的化合价分别是
A、+2、+2 B、+3、+3 C、+3、 +2 D、+2 、 +3
6、 2.1g平均相对分子质量为7.2的CO与H2的混合气体与足量的氧气充分燃烧后,立即通入适量的Na2O2固体中,固体的质量增加
A 2.1g B 3.6g C 7.2g D 无法计算
7、小明同学想从鸡蛋清溶液中提取有生理活性的蛋白质,你建议他选择的药品或方法是
A.饱和的硫酸铵溶液 B.浓硝酸
C.乙酸铅溶液 D.直接加热,然后进行过滤
8、12.4g Fe2O3和CuO的混合物与足量CO充分反应后固体减少3.1g,原混合物中Fe2O3和CuO的质量比是
(A)1∶1 (B)2∶1 (C)3∶1 (D)3∶2
9、将一严重锈蚀而部分变成铜绿[Cu2(OH)2CO3]的铜块研磨成粉末,在空气中充分灼烧成CuO,发现固体质量在灼烧前后保持不变,灼烧前粉末中铜单质的质量分数是
(A)52.8% (B)50% (C)70% (D)48.3%
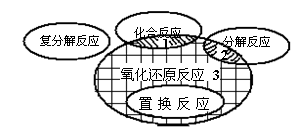 10、在化学反应前后,物质所含元素化合价发生变化的反应是氧化还原反应。它与九年级所学的化学基本反应类型间的关系如图所示,则下列化学方程式中属于阴影3处的是
10、在化学反应前后,物质所含元素化合价发生变化的反应是氧化还原反应。它与九年级所学的化学基本反应类型间的关系如图所示,则下列化学方程式中属于阴影3处的是
|
B.CO2 + H2O == H2CO3
![]() C.CO + CuO=== Cu+CO2
C.CO + CuO=== Cu+CO2
D.Fe + CuSO4 == FeSO4 + Cu
11、将同样是绿豆大小的焊锡(锡铅合金)、锡、铅放在铁片上的周围,加热铁片的中心部分。你认为最先熔化的是
A.锡 B.铅 C.焊锡 D.同时熔化
12、将Na2CO3·10H2O与NaHCO3的混合物mg溶解在水中,配成100mL水溶液,测得溶液中钠离子的质量为0.92g,若将该溶液蒸干灼烧直至质量不变,可得固体的质量为
A 2.55g B 2.12g C 1.86g D 无法计算
13、做电解水的实验时,为增强水的导电性,将4克NaOH加入到55克水中完全溶解,电解一段时间后产生了1克H2。此时溶液中的NaOH的质量分数是
A.8.7% B.8% C.7.3% D.6.8%
14、在有机化合物中,有一大类物质的分子组成具有Cm(H2O)n的特征,我们称它为糖类。例如:淀粉(C6H10O5)n是一种糖类,可以把它写成C6n(H2O)5n的形式。现有下列物质:
①蔗糖 C12H22O11 ②纤维素(C6H10O5)n ③苯酚C6H6O ④葡萄糖C6H12O6 ⑤氨基乙酸C2H5O2N ,其中属于糖类的是
A.①②④ B.②③④ C.②④⑤ D.④⑤
15、t℃时,在饱和硫酸铜溶液中加入少量白色硫酸铜粉末,溶液保持t℃,下列叙述正确的是 ①有蓝色晶体析出 ②饱和溶液总质量不变 ③饱和溶液中溶质质量减少 ④饱和溶液中溶剂质量减少 ⑤饱和溶液的质量分数减少 ⑥饱和溶液的浓度不变
A、①③④⑥ B、①③④⑤ C、①②⑥ D、①⑤
二、不定项选择(每题有1~2个选项符合题意)
16、某气体由H2、CO2、CO、CH4中的一种或两种组成,为确定其成分进行了下面的实验:
①将气体通过澄清的石灰水,未出现浑浊现象②将气体通过灼热的氧化铜,有红色固体生成③将气体点燃后通入澄清的石灰水,有浑浊现象,导出后再通入无水硫酸铜,白色粉末变蓝色。推断该气体成分,合理的是
A、H2、CO B、CO C、CO2、H2 D、CO2、CH4
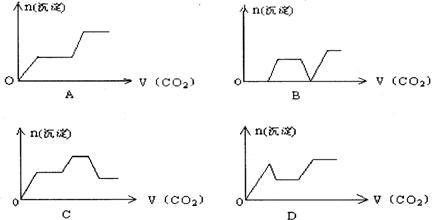 17、将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中(已知:KAlO2能与酸溶液反应生成氢氧化铝和钾盐,又能与碱溶液反应生成KAlO2溶液),生成沉淀与通入CO2的量的关系可表示为
17、将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中(已知:KAlO2能与酸溶液反应生成氢氧化铝和钾盐,又能与碱溶液反应生成KAlO2溶液),生成沉淀与通入CO2的量的关系可表示为
18、已知氧化还原反应中存在如下关系:强氧化剂+强还原剂→弱氧化剂+弱还原剂,现有下列三个能反应的式子:2W- + X2 →2X- + W2 2Y- + W2 → 2W- + Y2 2X- + Z2 → 2Z- + X2
以上反应均在同温、同压、同浓度下进行,正确结论是
A.氧化性是:Y2>X2 B.还原性是:Y->Z-
C.2Z- + Y2 → 2Y- + Z2的反应能够进行
D.在2KClO3+I2 2KIO3+Cl2↑中, I2的还原性强于Cl2
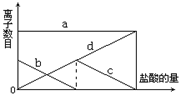 19、向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
19、向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
A.a:Cl—; b:K+; c:CO2- 3; d:HCO- 3
B.a:K+; b:CO2- 3; c:Cl—; d:HCO- 3
C.a:K+; b:CO2- 3; c:HCO- 3;d:Cl—
D.a:K+; b:HCO- 3; c:Cl—; d:CO2- 3
20、下表中“一”表示相连的物质间能发生反应,“→”表示这种物质可转化为另一种物质。甲、乙、丙、丁四种物质符合对应“转化关系”的是
| A | B | C | D | ||
| 转化关系 |
|
|
|
| |
| 物质 | 甲 | C | Na2CO3 | NaHCO3 | Fe |
| 乙 | O2 | Ca(OH)2 | CaCO3 | HCl | |
| 丙 | CuO | MgCl2 | NaOH | CuCl2 | |
| 丁 | CO2 | 稀H2SO4 | Na2CO3 | NaOH | |
得分________________________
| 请将选择题答案填入此表中(每题2分,共40分) | ||||||||||
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | ||||||||||
(第二卷 非选择题)
三、分析说明(每空1分,共39分)
21、除去下列物质中的少量杂质(括号内是杂质),从硝酸钡溶液、碳酸钠溶液、硝酸银溶液、铁粉中选择适当的试剂,将试剂填写在横线上。
(1)KNO3(KCl)_______________ (2)HNO3(H2SO4)_______________
(3)FeCl2(CuCl2)_______________
22、用右图中的装置可进行气体和固体的反应。
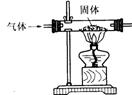 (1)请在下表中写出三组不同的反应物(三组气体必须各不相同)。
(1)请在下表中写出三组不同的反应物(三组气体必须各不相同)。
| 组别 | 固 体 | 气 体 |
| 1 | ||
| 2 | ||
| 3 |
(每组答案1分)
(2)请在上述三组中,挑选出有气体产物生成的一组是 (填入组别编号)。画出检验该气体产物所需的装置,并指明所画仪器中盛放药品的名称。(1分)
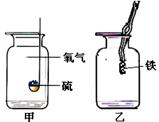 23、右图所示的甲、乙两个实验,集气瓶底部预分别装有
23、右图所示的甲、乙两个实验,集气瓶底部预分别装有
少量氢氧化钠溶液和水。它们的作用分别是:
甲中 ,
乙中 。
24、小华同学在测量不同溶液的酸碱度对头发的影响实验时:
将3束同一个人的头发分别在PH为1、7、14的溶液中浸泡30分钟后,取出用水冲洗干净,然后观察现象,她的操作是否正确_________,如果不正确请说出正确的操作办法________________________________________________________________________。做这个探究实验后,观察到光泽度最差的是用PH=_______的溶液浸泡过的头发;分别取一根头发最容易拉断的是用 PH=_____的溶液浸泡过的头发。由此可以想到不能用________溶液来洗头。
 25、如图所示,两实验设计中的最重要的两点差别是
25、如图所示,两实验设计中的最重要的两点差别是
①_________________________________________
②__________________________________________
为什么这样设计____________________________
26、金属镁可与热水反应生成一种碱和一种气体。某同学将镁条放在热水中煮沸,趁热取出部分溶液,滴加酚酞试液,溶液变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。请根据以上信息回答:
⑴镁条与热水反应的化学方程式为 ;
⑵反应后溶液滴加酚酞试液变红色,说明 ;
⑶请你对放置一段时间后溶液红色褪去这种现象进行探究。(只要提出假设、方案,不需要说出方案实施的具体结果)
假设一: 热的Mg(OH) 2溶液与空气的CO2反应,生成盐,溶液褪色。
方案一:向热的Mg(OH)2溶液中滴加酚酞试液,再通入CO2,观察溶液颜色变化。
假设二:_____________________________。方案二:_____________________________。
27、向一盛有无色溶液的试管中加入另一种无色溶液,生成了一种白色沉淀。试根据你学过的酸、碱、盐的知识和题目要求,推测生成的白色沉淀和对应的两种无色溶液各是什么。
(1)推测一:如果沉淀不溶于稀硝酸,沉淀可能是 ,两种无色溶液中的溶质分别是 ;
(2)推测二:如果白色沉淀溶于稀硝酸且有气体产生,沉淀可能是 ,两种无色溶液中的溶质分别是 ;
(3)推测三:如果白色沉淀溶于稀硝酸但不产生气体,沉淀可能是 ,两种无色溶液中的溶质分别是 。
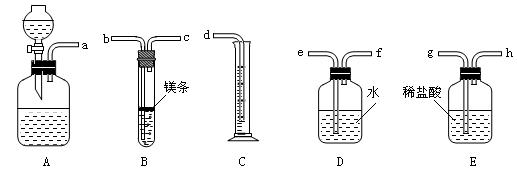 28、欲在室温和1.01×105Pa条件下测定镁的相对分子质量,请利用下图给定的仪器(盛放镁条的隔板有小孔)组装成一套实验装置(每种仪器只允许用一次)。请回答下列问题:
28、欲在室温和1.01×105Pa条件下测定镁的相对分子质量,请利用下图给定的仪器(盛放镁条的隔板有小孔)组装成一套实验装置(每种仪器只允许用一次)。请回答下列问题:
(1)装置A中的分液漏斗中盛放的液体是 ,其作用是
;
(2)假设气流方向由左向右,则各仪器的接口连接的先后顺序为(填小字母) ;
(3)连接好仪器后,要进行的操作有以下几步:①待仪器B中的物质恢复到室温时,测得量筒C中水的体积(若假设将测定的体积换算为标准状况下为VmL);②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为mg),并将其投入试管B中;③检查各装置的气密性;④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。上述几步操作的先后顺序为 ;
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所得镁的相对原子质量数据(选填“偏高”或“偏低”或“无影响”) ;
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量数据(选填“偏高”或“偏低”或“无影响”) 。
29、为了确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。已知氧化铁和铝在高温下反应生成氧化铝和铁;铝和氢氧化钠的水溶液反应生成偏铝酸钠(NaAlO2)和氢气。
(1)若取ag样品,向其中加入足量的氢氧化钠溶液,测得生成的气体为bg。反应的化学方程式为 ,样品中铝的质量为 g;
(2)若取ag样品,使其在高温下恰好完全反应,该反应的化学方程式为 ,样品中氧化铁与铝的质量比为 ;
(3)待(2)中反应产物冷却后,往其中加入足量的盐酸,测得生成的气体质量为cg,则该气体与(1)中所得的气体的质量比c∶b= 。
四、综合探究(除特别说明外,每空1分,共21分)
30、 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL(足量)稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:
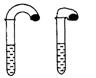 ①试管中(填产生沉淀或气体及反应速率等相关现象)
①试管中(填产生沉淀或气体及反应速率等相关现象)
_________________________________________________________ _ 。
②盛_______________的试管中气球变得更大,大小气球(包含试管)体积之比约为(填最简整数比)_________________;
③等质量的两种固体完全反应后生成气体质量不等,但等质量的稀盐酸完全反应后生成气体质量相等,这个结论正确吗?___________________
(2)为研究是吸热还是放热反应,继续进行了下列实验(每个实验各做3次,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 2.5g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10mL水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 2.5g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
①该研究报告的题目是《_______________________________________ _》
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_______________和_________________;通过上述实验可得出四条结论:
a:NaHCO3 的溶解是____________(吸热或放热)过程;
b:Na2CO3 溶解是____________(吸热或放热)过程;
c:NaHCO3 的饱和溶液和盐酸的反应是____________(吸热或放热)反应;
d:Na2CO3的饱和溶液和盐酸的反应是____________(吸热或放热)反应;
31、 已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3 + 3C 高温 4Fe+3CO2↑或者为:Fe2O3 + 3C 高温 2Fe+3CO↑某同学设计一个实验,假定恰好完全反应,测定此反应中的气体生成物,实验装置如下图。
⑴实验中通入的气体是纯净干燥的N2,写出不用空气的主要理由 ,实验也不能用潮湿的氮气,原因是 。
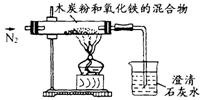 ⑵如用氧化铁与木炭粉的混合物3.8g反应,充分反应后测得固体质量减轻1.56g,则生成的气体为
。
⑵如用氧化铁与木炭粉的混合物3.8g反应,充分反应后测得固体质量减轻1.56g,则生成的气体为
。
⑶烧杯内适量澄清石灰水的现象为_________________,
若氧化铁的质量与本次实验相同,要使澄清石灰水的现象也与本次实验相同,则固体混合物总质量(m)的取值范围应该是___________________________________。
⑷合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
①当催化剂中FeO与Fe2O3的质量之比为9:20时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为________________。(2分)
②以Fe2O3为原料制备上述催化剂,可向其中加入适量碳,发生如下反应:
2Fe2O3+C![]() 4FeO十CO2↑
4FeO十CO2↑
为制得这种活性最高的催化剂,应向480g Fe2O3 粉末中加入碳多少克 ?(3分)
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | B | C | D | A | A | A | A | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | B | B | A | A | AB | C | BD | C | C |
21、(3分)(1)AgNO3溶液 (2)Ba(NO3)2溶液 (3)Fe 粉
22、(1) 其它合理答案,也可以
| 组别 | 固 体 | 气 体 |
| 1 | 炭粉 | 二氧化碳 |
| 2 | 氧化铜 | 氢气 |
| 3 | 氧化铜 | 一氧化碳 |
(2) 任选一组,画图即可
23. 吸收燃烧产物,防止SO2 污染空气;
防止生成的红热熔融物掉落瓶底,使集气瓶破裂;
24、不正确;头发取出后应该用纸巾吸干液体后继续进行观察和实验;14,1,酸性或碱性太强的。
25、 ①试管封闭与敞开的差别;②试管口略向下倾斜与试管横放的差别;
CO有毒,要防止中毒;氢气还原氧化铜生成水,防倒流。
26、⑴Mg+2H2O=Mg(OH)2+H2↑⑵溶液呈碱性 ⑶假设二:温度降低溶解度变小;方案二:加热褪色的溶液,观察溶液颜色变化。(其余合理答案亦可)
27.(1)AgCl、AgNO3和NaCl (2)BaCO3、BaCl2和Na2CO3 (3)Mg(OH)2、MgCl2和NaOH (每个空格1分,共6分,其余合理答案亦可)
28.(1)水;使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
(2)a、h、g、b、c、f、e、d (3)③②④①
(4)偏低 (5)偏高(每个空格1分,共6分)
![]() 29.(1)2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑; 9b
29.(1)2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑; 9b
(2)2Al + Fe2O3 2Fe + Al2O3; 80∶27 (3)2∶3
30.(1)①两支试管中都产生大量汽泡,但盛NaHCO3的试管中反应速要快得多(1分)
② 盛NaHCO3的试管中气球变得更大(1分) 53∶42(1分)
③不正确(1分)
⑵①《NaHCO3、Na2CO3和盐酸反应过程中热效应的研究》(1分)
②托盘天平(1分) 温度计(1分)
a.吸热 (1分) b.放热 (1分) c.吸热 (1分) d.放热 (1分)
31、⑴空气中的O2、CO2会与木炭反应生成CO、CO2 水会与木炭反应生成CO
⑵CO、CO2的混合物 ⑶变浑浊 3.2 g<m<3.92g
⑷解 : ① m(FeO):m(Fe2O3)=9:20
混合物中铁的质量分数为: (56 ÷ 72×9+112 ÷ 160 × 20 )/29=0.72 ( 2 分〉
②设需要加入碳 x
2Fe2O3+C==4FeO+CO2 ↑
320 12 288
(320/12)x x (288/12)x
(288/12)x :[480-(320/12)x]=9:20 x=6g (3 分)