中考化学打开材料之门题汇编
一、选择
1.(青岛市)下列对有关实验现象的描述正确的是(BD)
A.铁丝在空气中燃烧时,火星四射,有黑色物质生成
B.红热木炭放入盛有氧气的集气瓶中,剧烈燃烧,产生白光
C.石蜡在氧气中燃烧时,有水和二氧化碳生成
D.向硫酸铜溶液中滴加氢氧化钠溶液,有监色沉淀生成
2.(青岛市)实验课上,小明同学把一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液。下列判断中正确的是(AD)
A.滤出的固体中一定含有银,可能含有铜
B.滤出的固体中一定含有银和铜,一定不含锌
C.滤液中一定含有硝酸铜,一定没有硝酸锌和硝酸银
D.滤液中一定含有硝酸锌和硝酸铜,可能含有硝酸银
3.(枣庄市)现有5种物质:①浓盐酸 ②烧碱 ③食盐 ④浓硫酸 ⑤铁 把它们长期露置在空气中,其中发生化学变化且质量增加的是(B)
A.①② B.②⑤ C.③④D.③⑤
4.(枣庄市)图表资料可以为我们提供很多信息,下列从图表中获取的信息及应用不正确的是(B)
A.根据金属活动性顺序表,判断金属是否容易被盐酸腐蚀
B.根据金属的熔点数据表,判断金属的导电性强弱
C.根据溶解度曲线图,选择从溶液中获得晶体的方法
D.根据元素周期表,查找元素的原子序数、元素符号、相对原子质量等信息
5.(烟台市)下列关于实验现象的描述,正确的是(BC)
(A)镁条在空气中燃烧,发出白色火焰,生成白色粉末
(B)细铁丝在氧气里剧烈燃烧,火星四射,放出热量,生成黑色固体物质
(C)加热试管里的硫酸铜晶体,蓝色晶体逐渐变成白色粉末,在试管口部有液滴出现
(D))蜡烛在氧气里燃烧比在空气里燃烧得更旺,发出白光,放出热量,生成二氧化碳气体使澄清的石灰水变浑浊
6.(烟台市)下列事实中,能说明铁的金属活动性比铜强的是(BD)
(A)铁的年产量比铜高 (B)铁桶不能用来盛装农药波尔多液
(C)铁的硬度比铜大 (D)相同条件下,铁比铜更易被腐蚀
7(济南市).向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为(D)
A..Ag、Cu两种单质的混合物 B.Cu、Fe两种单质的混合物
C. .Ag、Fe两种单质的混合物 D. Ag、Cu、 Fe三种单质的混合物
8. (济南市)一定量铜粉和镁粉的混合物与足量稀硫酸完全反应,过滤,所得固体不溶物在加热条件下与足量氧气充分反应后,所得产物的质量是原混合物质量的一半,则原混合物中铜粉和镁粉的质量比为下列的(C)
A. 1 :1 B. 4 :3 C. 2 :3 D. 3 :2
9.(临沂市2007年)在CuO和Fe的混合物中,加入一定量的稀H2SO4并微热。当反应停止后,滤出不溶物,再向滤液中放入一粗铁丝,片刻后取出铁丝,发现粗铁丝无任何变化。据此,你认为下列结论正确的是(提示CuO+H2SO4=CuSO4+H2O)(B)
A.不溶物一定是铜
B.不溶物中一定含有铜,也可能含有铁
C.滤液中一定含有H2SO4,也可能含有CuSO4
D.滤液中一定含有FeSO4,也可能含有CuSO4 和H2SO4
10.(太原市)下列与铁有关的说法正确的是(A)
A.生铁和钢都是铁的合金B.炼铁是把单质铁变成氧化铁的过程
C.铁制污水管道可常用废酸液冲洗D.被腐蚀的铁制品属于不可回收垃圾
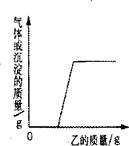 11.(泰安市)向下表的甲物质中逐滴加入相应的乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系能用右图所示曲线表示的是(B)
11.(泰安市)向下表的甲物质中逐滴加入相应的乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系能用右图所示曲线表示的是(B)
| 序号 | 甲 | 乙 |
| ① | 铜、锌的混台物 | 稀盐酸 |
| ② | 硫酸和硫酸铜的混合溶液 | 氢氧化钠溶液 |
| ③ | 盐酸和稀硫酸的混合溶液 | 氯化钡溶液 |
| ④ | 生锈的铁钉 | 稀盐酸 |
A.①② B.②④ C.③④ D.只有④
12.(上海市)下列物质中,不属于有机物的是( B )
A、葡萄糖 B、石碱 C、酒精 D、淀粉
二、填空
1.(山东省)把一小包铁粉放入一定量的硝酸铜溶液中,使其充分反应后,过滤、洗涤、干燥,得到固体。请你对固体的成分进行探究。
(1)猜想:固体的成分可能 是______________________________________。
(2)实验:请设计实验验证你的猜想。说明实验过程、现象和结论。
______________________________________________________________________________________________________________________________________________________。
(1)铜(或铁和铜的混合物) (1分)
(2)向固体中加入适量的稀盐酸,固体不溶解,原来的固体是铜。(或向固体中加入过量的稀盐酸,固体部分溶解,且有气泡产生,则原来的固体是铁和铜的混合物。) (2分)
2.(江西)请将下列短文中带点的部分,用恰当的化学用语填写在横线上:
太阳镜具有保护眼睛的功能。它的镜脚一般是由塑料(其中含有碳元素 )制成的,玻璃镜片的主要成分是二氧化硅 ,且变色玻璃中含有银离子 ,铜制镜框使用时间过长会生成铜绿[Cu2(OH)2CO3],铜绿中氢氧根离子的化合价显—1价 。
C;Si02;Ag+;Cu2(OH)2C03
3.(江西)特快电热壶由于快捷方便,被许多家庭、宾馆使用。请据图示回答:
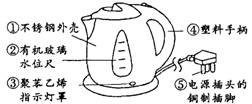 (1)制作材料中属于金属或合金的是 (选填一种
(1)制作材料中属于金属或合金的是 (选填一种
物质编号,下同),属于有机物的是 ;
(2)制作手柄的塑料属于——塑料,(填“热塑性”或
“热固性”);
(3)用铜质材料制作电源插头的插脚是利用铜具有
性;
(4)这种水壶具有水沸自动断电保护功能,即水沸后因气压增大使电源开关自动断电。
分子的角度解释水沸后气压增大的原因: 。
(1)①或⑤; ②(或③、④) (2)热固性
(3)导电 (4)受热时水分子运动加快,分子间的间隔增大
三、实验
1.(威海市)已知一种固体化合物由C、H、O、Cu四种元素组成。向盛有该化合物的试管中加入稀盐酸,产生大量气泡,固体逐渐溶解,得到蓝绿色溶液。己知这种蓝绿色是氯化铜溶液。
(1)探究产生的气体是什么。
【猜想】①可能是氢气;② ③ ……
【实验】请针对你②和③猜想中的一种,设计实验,验证你的猜想。 。
(2) 从蓝绿色溶液中提取金属铜。现利用该溶液制取金属铜,过程如下:
 |
①操作1的名称为 ,完成该实验需要的主要仪器有
,加入过量的A的目的是 ,反应化学方程式为 。
②加入足量B的目的是 ,如何确定此目的已经达到? 。
共12分。第(1)小题4分,第(2)小题8分。其中方程式和仪器各2分,其余每空1分。
(1)可能是氧气;可能是二氧化碳(或答可能是一氧化碳、甲烷等也正确)。用带火星的木条试验,木条复燃,证明是氧气;(或将气体通入澄清的石灰水,石灰水变浑浊,证明是二氧化碳;或将气体点火,气体能燃烧,用干而冷的烧杯罩在火焰上,烧杯内壁出现水珠,迅速将烧杯倒过来,注入少量澄清石灰水,石灰水变浑浊,证明是甲烷)。
(2)①过滤带铁圈的铁架台、漏斗、玻璃棒、烧杯使溶液中的氯化铜完全反应
Fe+CuCl2=FeCl2+Cu(或Zn+CuCl2=ZnCl2+Cu等,答案合理即可)
②完全除去过量的A 溶液中不再有气泡产生,则说明目的已经达到。
2.(陕西省)下图是实验室用一氧化碳还原氧化铁的实验装置图,试回答:
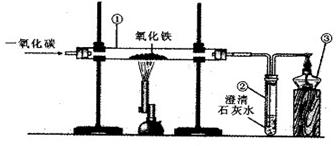
(1)仪器③的名称是 。
(2)实验过程中仪器①中的现象是 ,仪器②中发生反应的化学方程式是 。
(3)实验过程中的尾气不能直接排入大气中的原因是 。
(1)酒精灯 (2)固体由红色变黑色 Ca(OH)2 + CO2 = CaCO3↓+ H2O
(3)CO有毒会污染空气
四、计算
1.(石景山区)(3分)甲、乙两组同学分别对一种“铜锌合金”进行了如下探究:
【提出问题】该铜锌合金中铜的质量分数是多少?
【查阅资料】⑴该合金结构紧密,所含的锌只有部分与盐酸反应;
⑵该合金能全部溶于稀硝酸,生成Cu(NO3)2和Zn(NO3)2的混合溶液。
【设计并实验】
甲组:称取7.4 g合金,放入足量的盐酸中直到反应停止,收集到0.02 g氢气。
乙组:称取7.4 g合金,放入足量的稀硝酸中,全部溶解后加入足量的铁,完全反应,得到6.66 g铜。
【数据处理】根据上述实验结果,请你帮助他们分别计算出合金中铜的质量分数。
甲组:
乙组:
【反思与评价】实验不合理的组是 ,其原因是 。
甲组:设产生0.02 g H2需要锌的质量为x。
Zn + 2HCl = ZnCl2 + H2↑
65 2
x 0.02 g
![]()
x=0.65 g
合金中铜的质量分数为![]() ……………………………(1分)
……………………………(1分)
乙组:合金中铜的质量分数为:![]() ………………………(1分)
………………………(1分)
甲 甲组实验方案中的锌未完全反应,所以测得铜的质量分数偏高………(1分)
(其他解法合理且正确均给分)