八年级科学分类复习测试卷
分类复习测试卷(粒子的模型和符号)
可能用到的相对原子质量:H—l C—12 N一14 O-16 S一32 C1—35.5 Ca一40
一、选择题(本题包括25小题,每小题2分,共50分。注意:每小题只有一个选项符合题意,请将符合题意的选项序号填入题后的括号内)
1、不同的事物可用不同的符号来表示,下列关于符号特点的说法不确切是( )
A、简明性 B、完整性 C、统一性 D、方便性
2、掌握消防知识对我们来说非常重要,下列公共标志中,与消防安全有关的是( )
|
A、①② B、②③ C、③④ D、①④
![]()
![]() 3、用“ ”表示氧原子,用“ ”表示氢原子,水电解中不能再分的粒子是( )
3、用“ ”表示氧原子,用“ ”表示氢原子,水电解中不能再分的粒子是( )
![]()
![]()
![]()
![]()
![]()
![]() A、
B、
C、
D、
A、
B、
C、
D、
4、最接近真实原子结构的原子模型是( )
A、道尔顿模型 B、电子云模型 C、汤姆森模型 D、卢瑟福模型
5、下列关于分子、原子的说法中,错误的是( )
A、分子和原子都是构成物质的微粒 B、分子和原子都在不断地运动
C、分子可以再分,原子不能再分 D、分子都是由原子构成的
6、下列现象或操作与分子对应的特性不一致的选项是( )
| 选项 | 现象或操作 | 分子特性 |
| A | 充满气的车胎不易压缩 | 分子有一定的质量 |
| B | 10ml酒精与10ml水混合后总体积小于20ml | 分子间有间隔 |
| C | 桌子上的水滴一会儿没有了 | 分子在不断运动 |
| D | 水通直流电产生氢气和氧气 | 分子可以再分 |
7、著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动放射出一些粒子。一种元素的原子经过放射变成了另一种元素的原子,则此原子放射出的粒子一定是( )
A、电子 B、中子 C、质子 D、原子核
8、2004年诺贝尔物理学奖颁给了美国三位科学家格罗斯、波利茨、威尔茨克,他们对有关原子核内夸克之间存在的强作用力的研究方面作出了重要的理论发现。有关夸克的说法,不正确的是( )
A、夸克是目前发现的最小基本粒子 B、质子和中子都由夸克构成
C、不是所有分子中都存在夸克粒子 D、夸克研究是一个科学研究的热点
![]()
![]() 9、下图是四种不同物质内部的分子模型,图中“ ”
和“ ”分别表示两种不同原子,则属于化合物的是(
)
9、下图是四种不同物质内部的分子模型,图中“ ”
和“ ”分别表示两种不同原子,则属于化合物的是(
)
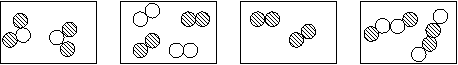 |
A B C D
10、人类已知的元素有110多种,则意味着( )
A、已知的原子有110多种 B、已知的分子有110多种
C、已知的单质有110多种 D、以上说法均错
11、某物质中只含一种元素,下列推断正确的是( )
A、该物质一定是单质 B、该物质一定不是化合物
C、该物质一定是纯净物 D、该物质一定是混合物
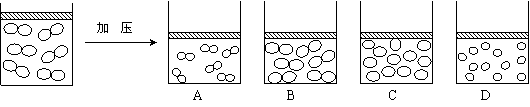
12、有一密封容器储有一定量氧气,上面有一个不漏气的活塞,慢慢下压活塞,密封容器内部分子变化模型合理的是( )
13、氕、氘、氚三种原子具有相同的( )
A、原子质量 B、原子核结构 C、核电荷数 D、中子数
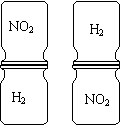 14、把红棕色的NO2气体和无色的H2的集气瓶,按如右图两种方式放置,然后抽去两瓶之间的玻璃片,可观察到左边的两瓶气体的颜色很快趋于一致,右边的两瓶需较长时间才能达到同样的效果,由此现象不能得出的结论是( )
14、把红棕色的NO2气体和无色的H2的集气瓶,按如右图两种方式放置,然后抽去两瓶之间的玻璃片,可观察到左边的两瓶气体的颜色很快趋于一致,右边的两瓶需较长时间才能达到同样的效果,由此现象不能得出的结论是( )
A、分子是在不断运动 B、分子之间有间隔
C、氢气的密度比二氧化氮小 D、分子由原子构成
15、符号“O2 ” 除表示氧气外,还可表示( )
①氧元素 ②一个氧分子 ③二个氧原子 ④氧气是由氧元素组成
⑤每个氧分子由两个氧原子构成 ⑥氧气的相对分子质量为32
A、①②③④ B、②④⑤⑥ C、②④⑤ D、①③④
16、我国计划在2007年发射一颗绕月探测卫星,其任务之一是寻找一种新能源—氦3,氦3的原子核是由一个中子和两个质子构成的,其原子核外电子数为 ( )
A.1 B.2 C.3 D.6
17、氯元素有多种化合价,它在高氯酸中显最高价。下列表示高氯酸的化学式为 ( )
A.HClO3 B.HClO4 C.HClO D.HCl
18、二氧化碳(CO2)中含有( )
A、氧元素 B、氧气 C、一个氧分子 D、二个氧原子
19、某分子的结构模型如右图所示。下列有关此分子的说法,错误的是 ( )
 A、此分子中有5个原子
A、此分子中有5个原子
B、此分子的分子式是CH4
C、由此分子组成的物质由2种元素组成
D、由此分子的相对分子质量为16克
20、下列图中,符合2N2意义的示意图是( )
 |
|
21、下列粒子中,能保持氢气化学性质的是( )
A、H B、H+ C、H2 D、2H
22、一种碳原子的质量为a千克,X原子的质量为b千克,则X原子的相对原子质量为( )
A、a/12b B、12a/b C、b/12a D、12b/a
23、由A和B两种元素组成的化合物中,已知A和B的元素质量比为21:8,而A和B的相对原子质量之比为7:2,则该化合物的化学式为( )
A、A2B3 B、A3B4 C、A2B5 D、AB
24、钙是构成人体骨骼和牙齿的重要成分,这里的“钙”是指( )
A、钙单质 B、钙元素 C、钙原子 D、钙离子
25、在学习固体、液体、气体的微观结构时,老师带领同学们做游戏,用人群的形态类比物质的微观状态。下图所示甲、乙、丙三种情景分别对应的是( )
 |
A、固态、液态、气态 B、气态、固态、液态
C、固态、气态、液态 D、液态、气态、固态
二、填空题(本题第27题,第30题每空0.5分,其余每空1分,共42分。)
26、分子是保持物质______________的最小粒子。原子是____________________的最小粒子。 它由居于原子中心的_____________和________________构成的。不同种类的原子,它们的原子所含_____________数不同。最早提出原子理论的科学家是_______________。
27、写出下列内容的符号:
①钙元素_______②n个氮原子_______③氢分子______④冰_______⑤二个硝酸根离子_____
28、在原子结构模型建立过程中,科学家是根据科学实验中不断发现的事实来建立和修正原子结构模型的。下列科学事实的发现分别提出了什么原子结构模型:
(1)原子中发现有电子存在:______________
(2)用α粒子轰击金属箔,少数α粒子的方向偏转或弹回__________________
29、已知叶绿素的化学式为(C35H74O5N4Mg),由此可知组成叶绿素的元素有_______种,其中,碳氢二种元素的质量比为_______。每个叶绿素分子中共有__________个原子。
30、用元素符号把下表填完整:
| H | |||||||
| Li | Be | B | O | ||||
| Al | P | S | Ar | ||||
元素周期表中,同一周期从左到右,元素原子的核电荷数逐渐 (填“增加”或“减少”),同一族元素的 性质都很相似(填“物理”或“化学”)。
31、某物质化学式为H n RO2 n+1,相对分子质量为M,则元素R的化合价是________,R的相对原子质量为______________。
32、下列物质各1克,相同状况下所含分子数由多到少的次序______________________
(填编号) ①一氧化碳 ②氧气 ③二氧化碳 ④氢气
33、铁元素与氧元素可以形式三种化合物:氧化铁(Fe2O3)、氧化亚铁(FeO)、四氧化三铁(Fe3O4),则它们所含铁元素的质量分数由大到小的顺序是____________________________。
34、前不久,美国夏威夷联合天文中心的科学家发现新型氢粒子,它的组成可以用H3+ 表示。
(1) 该粒子属于________________(填分子、原子或离子)
(2) 2个H3+粒子中含有_________个质子,_________个电子。
35、物质之间既有相互联系,又存在着一定的规律,主要在于你在发现、去挖掘,这是我们学好科学的一种基本方法,请仿照示例,找出O2、CO2、He、CH4、NH3(氨气)五种气体之间存在的另外两个规律,并排出顺序,填入表中。
| 规 律 | 排 列 顺 序 |
| 示例:标准状况下,密度由小到大 | He、CH4、NH3、O2、CO2 |
36、对某种赤铁矿进行测定分析,发现其含主要成分氧化铁Fe2O3的质量分数为80%,则其含铁元素的质量分数为__________________。(杂质不含铁元素)
37、18克水通电分解,在正极上得到的气体的质量是_____________克。
38、石膏与硫酸铜晶体一样,也是一种结晶水合物,受热会失去结晶水。小明同学和小王同学为了测定石膏中结晶水的含量,设计了如图实验装置。
小明同学的实验步骤如下:
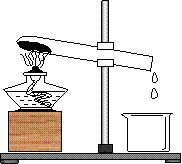 A. 用天平测出干燥空试管的质量为m克
A. 用天平测出干燥空试管的质量为m克
B. 把适量石膏放入试管,测出试管总质量为n克
C. 按装置对试管加热,直到不再有水产生为止
D. 冷却后称量,测得试管及剩余物总质量为a克
小王同学的实验步骤如下:
A、用天平测出干燥空试管的质量为m克
B、把适量石膏放入试管,测出试管总质量为n克
C、按装置对试管加热,直到不再有水产生为止
D、测得烧杯内水的质量有b克
(1)小明同学测得的石膏中结晶水质量分数为_________________________
(2)小王同学测得的石膏中结晶水质量分数为_________________________
(3)你认为哪位同学方案不够科学______________,他测得的结果比真实值________(填偏大或偏小),原因是___________________________________________________________。
(4)石膏的化学式为CaSO4·2H2O,则结晶水的质量分数的理论值为__________________。
39、含有相同质量氧元素的CO和CO2 两瓶气体,这二瓶气体的质量比_______________
40、符号“ 3SO42- ”中:数字3的意义:___________________________________
数字2的意义:____________________________________
三、计算题:(第41题3分,第42题5分)
41、已知一个碳-12原子的质量为1.993×10-26千克,计算一个水分子的质量 。
42、已知尿素的化学式:CO(NH2)2
(1)计算尿素含氮元素的质量分数。
(2)几克尿素的含氮量与10克氨气(NH3)的含氮量相等?
(3)测得某人尿液中氮元素质量分数0.91%,则尿液中含尿素的质量分数多大?(设氮元素只存在于尿素中)
分类复习测试卷(粒子的模型和符号)答案
1、B 2、A 3、A 4、B 5、C 6、A 7、C 8、C 9、A 10、D 11、B 12、B
13、C 14、D 15、B 16、B 17、B 18、A 19、D 20、D 21、C 22、D
23、B 24、B 25、C 26、化学性质 化学变化中 原子核 核外电子 质子数 道尔顿 27、Ca nN H2 H2O 2NO3- 28、(1)汤姆森模型 (2)卢瑟福模型 29、5 210:37 119 30、略 增加 化学 31、3n+2 M-33n-16 32、④①②③ 33、FeO Fe3O4 Fe2O3 34、(1)离子 (2)6 5 35、分子中所含原子数由少到多:He、O2、CO2 、NH3 、CH4 相对分子质量由小到大:He、CH4、NH3、O2、CO2 36、56% 37、16 38、(1)n-a / n-m (2)b / n-m (3)小王 偏小 实验中有一部分水以水蒸气的形式散发到空气中了,使烧杯中的水偏少(4)20.9% 40、三个硫酸根离子 一个硫酸根离子带二个单位负电荷 41、2.99×10-26 千克 42、(1)46.7% (2)17.6克 (3)0.02 %