九年级科学第二章知识点
 第一节 物质的分类和应用
第一节 物质的分类和应用
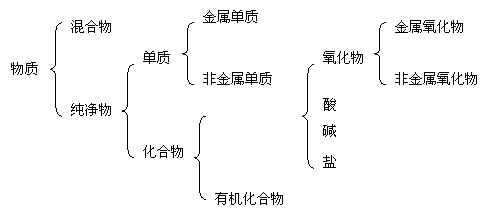
1、分类:
|
有机化合物一般含C、H等元素,因此燃烧后的产物为CO2和H2O
2、区别金属与非金属:
金属的特性:金属光泽、延展性、导电性、导热性、硬度大、密度和熔点高等。石墨虽然是非金属单质,具有良好的导电性。水银(汞)是唯一的液态金属。溴是唯一的液态非金属。金刚石是自然界硬度最大的物质。
第二节 物质转化的规律
| 一、非金属单质与其化合物的转化 1、S + O2==== SO2 (刺激性,有毒,污染空气) 4P + 5O2 ===== 2P2O5 (除去空气中少量氧气) C + O2 ==== CO2 (氧气充足) 2C + O2 ==== 2CO(氧气不足) | 二、金属单质与其化合物的转化 1、2Mg + O2==== 2MgO (发出耀眼强光,生成白色固体) 2Cu + O2 ==== 2CuO (红色的铜在空气中加热变黑色) 3 Fe + 2O2 ==== Fe3O4 (火星四射,生成黑色固体) |
|
CO2 + H2O ==== H2CO3 (CO2通入紫色石蕊试液变红色,加热又变紫色。) SO2 + H2O ==== H2SO3 SO3 + H2O ==== H2SO4 |
CaO + H2O ==== Ca(OH)2 K2O + H2O ==== 2KOH CuO、Fe2O3则不能,因其对应的碱不溶。 |
| 三、金属的冶炼 1、常见的三种还原剂:C 、CO 、H2等 C + 2CuO ===== 2Cu + CO2 3CO + Fe2O3 ===== 2Fe +3CO2 H2 + CuO ==== Cu + H2O 2、H2还原氧化铜实验: (1)现象:试管内黑色粉末变红色,试管口出现水珠; (2)操作步骤:实验开始时先通入H2,一段时间后再加热;实验结束后,先熄灭酒精灯,继续通H2,直到试管冷却。 3、氧化还原反应:
| |
四、化合物间相互转化规律
1、物质转化规律简图:

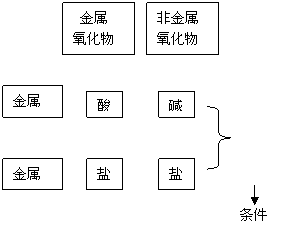
(1)任何酸和碱都能发生中和反应;
(2)任何碳酸盐和酸都能反应产生CO2气体。
(3)盐和盐、盐和碱的反应,反应物必须可溶。
2、以图为例,选择制取MgCI2的几种方法:
(1)金属+酸:Mg + 2HCI === Mg CI2 + H2
(2)金属+盐:Mg + CuCI2 === Mg CI2 + Cu
(3)酸+碱: 2HCI + Mg(OH)2 ==== Mg CI2 + 2H2O
(4)酸+盐: 2HCI + MgCO3 === Mg CI2 + H2O + CO2
(5)盐+盐: MgSO4 + BaCI2 === BaSO4 + Mg CI2
五、物质的鉴别:
1、盐酸及盐酸盐的检验:用AgNO3溶液和稀硝酸,反应生成不溶于硝酸的白色沉淀
HCI + AgNO3 ==== AgCI + HNO3
NaCI + AgNO3 ==== AgCI + NaNO3
2、硫酸及硫酸盐的检验:用BaCI2溶液和稀硝酸,反应生成不溶于硝酸的白色沉淀。
H2SO4 + BaCI2 ==== BaSO4 + 2HCI
Na2SO4 + BaCI2 ==== BaSO4 + 2 Na CI
3、碳酸盐的检验:用稀盐酸和澄清石灰水,反应产生使石灰水变浑浊的CO2气体。
CaCO3+ 2HCI ====CaCI2 + H2O + CO2
Na2CO3 +2 HCI==== 2NaCI + H2O + CO2
4、酸和碱的检验:酸碱指示剂或PH试纸。
六、物质的推断:寻找突破口。
1、常见沉淀
Cu(OH)2兰色沉淀;Fe(OH)3红褐色沉淀;AgCI、BaSO4白色沉淀且不溶于硝酸。
2、溶液颜色
Cu2+溶液蓝色:CuSO4溶液、CuCI2溶液为蓝色;
Fe3+溶液黄色:FeCI3溶液为黄色;
Fe2+溶液为浅绿色:FeCI2溶液、FeSO4溶液为浅绿色。
3、氧化铜和碳粉为黑色,铜为红色。
七、物质的俗称:
烧碱、苛性钠:NaOH ; 纯碱、苏打:Na2CO3 ; 熟石灰、消石灰:Ca(OH)2
生石灰:CaO ; 大理石、石灰石:CaCO3 ; 胆矾:CuSO4 5H2O
八、物质或离子能否共存问题:
1、相互间能发生反应产生沉淀、气体或水的,不能共存。
2、离子间能结合成沉淀、气体或水的,不能共存。例如:
H+和OH-,Ag+和CI-,Ba2+和SO42-,H+和CO32-等离子不能在同一溶液中共存。
3、背景:酸性溶液中有大量的H+,碱性溶液中有大量的OH- 。
第三节 常见的材料
一、金属材料
1、合金:几种金属熔合在一起,即形成合金。其性能比纯金属更好,硬度大。
2、钢和生铁:是铁和碳元素形成的合金。
3、金属锈蚀的条件:空气和水分。
4、金属防锈措施:

