2006高三理科综合化学部分测试题
一、单项选择题(每小题6分,共48分)
1、某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是( )
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验含碘盐中的碘酸钾(KIO3)
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
![]() 2、恒温下,
2、恒温下,![]()
![]() 反应达到平衡,把容器体积压缩到原来的1/2,达到新平衡时,X的物质的量浓度从0.1mol/L增大到0.19mol/L,下列判断正确的是
( )
反应达到平衡,把容器体积压缩到原来的1/2,达到新平衡时,X的物质的量浓度从0.1mol/L增大到0.19mol/L,下列判断正确的是
( )
A.a>b+c B.a<b+c C.a=b+c D.a=b=c
3、当前,我国正严防含有工业染色剂“苏丹红一号”的有毒食品流入市场。研究表明:核黄素(即维生素B2)能缓解“苏丹红一号”的毒性,其结构如右图
 下列有关核黄素的说法中,正确的是( )
下列有关核黄素的说法中,正确的是( )
A.核黄素属于分子晶体t
B.核黄素能发生银镜反应
C.核黄素能与氯化铁溶液作用呈紫色
D.核黄素不能被酸性高锰酸钾溶液氧化
4、在给定的四种溶液中,各离子能大量共
存的是( )
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I-
B.所含溶质为NaNO3的溶液:K+、HSO4-、Cl-、S2O32-
C.含有大量H+的无色溶液:Na+、Fe3+、NO3-、MnO4-
D.能使pH试纸变为蓝色的溶液:Na+、Cl-、S2-、SO32-
5、在一定温度时将x克某物质A完全溶解于50克水中,若将所得的溶液蒸发掉10克水后并恢复至原来温度,可析出A物质a克,再蒸发掉10克水后仍恢复至原温度,又析出A物质b克,最后将剩余溶液蒸干,得到A物质y克。若A物质不含结晶水,则x与y的比值为( )
A.(a+3b)/3b tx B.(a+4b)/4b
C.(a+3b)/2b D.(a+4b)/3b
6、设NA为阿伏加德罗常数。下列叙述正确的是
A.常温下,1molNaHCO3投入足量稀盐酸中,待反应结束后,可逸出NA个CO2分子
B.在含有NA个醋酸根离子(CH3COO-)的醋酸溶液中,氢离子(H+)数目略大于NA
C.1molCH3+(碳正离子)中含电子数目为10NA
D.46gNo2和N2O4混合气体中含有原子数为3NA
7、六氟化硫分子呈正八面体,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是( )
A.SF6易燃烧生成二氧化硫 B.SF6中各原子均达8电子稳定结构
C.高温下,SF6微弱水解x生成H2SO4和HF D.SF6是极性分子
8、每个公民都应该有安全意识,今年频繁发生的有关化学品泄漏或爆炸事件一次又一次给我们敲响了警钟。下列做法存在安全隐患的是
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌;②给试管中液体加热时,应将试管倾斜,与桌面成45°角,再集中在药品处加热;③取用金属Na或K时,用剩的药品要放回原瓶;④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏原因,并打开所有门窗通风;⑤在做苯酚性质实验时,因为常温时苯酚在水中溶解度较小,所以可以将废液直接通过水池排入水道;⑥废旧电池应回收处理。
A.全部 B.①②④⑤ C.①③⑤ D.①④
二、填空题(共60分)
9、(14分)2005年10月12日9时,我国在酒泉卫星发射中心成功的发射了“神舟”
六号载人飞船。将两名航天员同时送上天空,并于10月17日凌晨成功返回,
为我国家航天事业写下了新的篇章。
(1)火箭升空时,由于与大气层的剧烈摩擦,产和高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是___________;
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:![]() 。
。
请配平该反应方程式:____N2O4+___N2H4→___N2+___H2O
该反应中被氧化的原子与被还原的原子物质的量之比是________。 这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点____________。
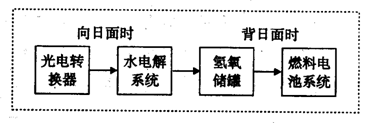
(3)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,水电解系统中的阳极反应为:___________________________,
燃料电池放电时的负极反应:_____________________________。
10、(12分)某固体X由两种常见元素组成,其中金属元素与另一非金属元素的质
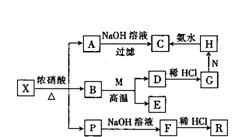 量之比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。P为混合气体,R是无色无味且能使澄清石灰水变浑浊的气体,E是密度最小的常见气体。常温下B为液体,C为红褐色沉淀,M为常见金属单质。
量之比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。P为混合气体,R是无色无味且能使澄清石灰水变浑浊的气体,E是密度最小的常见气体。常温下B为液体,C为红褐色沉淀,M为常见金属单质。
请填空:
(1)X的化学式为
(2)从不引入杂质的角度考虑,N可以选择下列物质中的 (填序号)。
A.KMn04 B.HN03 C.H202 D.Cl2
(3)写出反应D~G的离子方程式:
(4)写出反应B+M的化学方程式:
11.(18分)下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
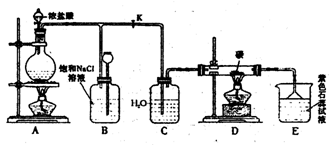 |
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D
处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式__________________________;装置C的作用是______________________________。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是__________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此是B中的现象是____________,B的作用是______________________。
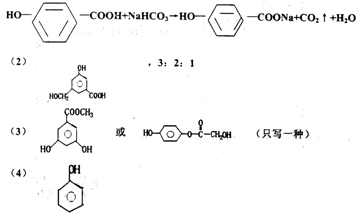
12、(16分)A、B、C、D均为含苯环的化合物,且式量B>A>C,
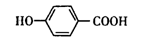
已知有机物A的结构简式为
 (1)A既能与NaOH溶液反应,又能与NaHCO3溶液反应,写出A和NaHCO3溶液反应的化学方程式____________________________
(1)A既能与NaOH溶液反应,又能与NaHCO3溶液反应,写出A和NaHCO3溶液反应的化学方程式____________________________
(2)有机物B在浓H2SO4存在下,相互作用生成一种环
状酯,如图则有机物B的结构简式为_______________,
等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、
NaOH、NaHCO3的物质的量之比为________。
(3)D和B互为同分异构体,且苯环上的一氯代物只两种,D不与NaHCO3反应,
能与Na、NaOH反应,等质量的D消耗Na、NaOH的物质的量之比为2∶3,则D
的结构简式为(只写一种):____________________________________
(4)1molA、C完全燃烧,消耗O2的质量相等,且1molC能和1molNa完全反应,
写出含碳原子数最少的C的结构简式____________________________________
参考答案
1、B 2、A 3、A 4、D 5、D 6、D 7、C 8、B
9.(1)B(2)1、2、3、4 2∶1
产物为氮气和水,不会污染环境 (3)![]()
![]()
10.(1)E、A、D Br2 (2)3Fe+4H2O =Fe3O4+4H2
(3)![]() 2NA
2NA
11.(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)2Cl2+C+2H2O![]() CO2+4HCl 提供反应需要的H2O
CO2+4HCl 提供反应需要的H2O
(3)先变红,后褪色 D中生成HCl使溶液变红,而剩余的Cl2生成的HClO使红色溶液褪色.
(4)B B中液面下降,长颈漏斗内液面升高 ,贮气装置
12.