塘栖中学2006届高三理科综合训练题(七) 2006-5-5
班级 姓名 学号
杭州市塘栖中学 余晓钟
一、选择题( 每小题只有一个选项符合题意)
6.下列有关叙述正确的是( )
 A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C. 右图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为:
2 A(g)+ B(g) = 2 C(g);△H=Q kJ·mol-1(Q<0 )
D.电解水制取氢气和氧气时,通常加入硫酸钠等强电解质,这说明强电解质的导电性比弱电解质的强
7.一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A.B4C是一种分子晶体 B.B4C是一种离子晶体
C.B4C是一种原子晶体 D.该分子是有4个硼原子和1个碳原子构成
8.6.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.100g98%的浓硫酸中含氧原子个数为4NA
B.1mol 苯分子中含有碳碳双键数约为3×6.20×1023
C.标准状况下,22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
D.60gSiO2晶体中含SiO2分子数约为6.02×1023
9. 某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是( )
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Ca2+、MnO4-、Cl-
C.Ba2+、Na+、AlO2-、NO3- D.NH4+、Fe3+、SO42-、SCN-
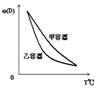
 10.一定温度下,有可逆反应:2A(g)+2B(g)
10.一定温度下,有可逆反应:2A(g)+2B(g)![]() C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
|
|
关于两容器中反应的说法正确的是( )
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成不相同,混合气体的平均相对分子质量也不相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2 所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度是乙中物质C的浓度的2倍
11.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法不正确的是( )
A.电池工作时,电子由正极通过外电路流向负极
B.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
 D.电池工作时,锌失去电子
D.电池工作时,锌失去电子
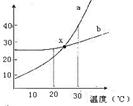
12. 如图是a、b两种固体物质的溶解度曲线,下列说法中错误的是( )
A.a中含有少量b时可以用结晶法提纯a
B.20℃时,a和b饱和溶液的物质的量浓度:a<b
C.30℃时,a和b饱和溶液的质量分数:a>b
D.x点表示的a和b溶液都是饱和溶液
13. 有编号为1、2、3、4的四瓶无色液体,仅知道是1%酚酞、0.1mol/LNaOH溶液、0.1mol/L盐酸和0.1mol/LNaCl溶液,现要求甲、乙、丙、丁四位学生进行鉴别,而且每人只鉴别两瓶溶液,告诉学生鉴别两瓶溶液都正确得满分,只有一瓶正确可以及格。
四位学生的鉴别结果如下:
| 甲 | 1号为0.1mol/L盐酸 | 4号为0.1mol/LNaCl溶液 | 老师评价:四位学 生都及格,但是没 有一个得满分 |
| 乙 | 1号为0.1mol/LNaOH溶液 | 3号为0.1mol/L盐酸 | |
| 丙 | 1号为1%酚酞 | 2号为0.1mol/L盐酸 | |
| 丁 | 4号为0.1mol/L盐酸 | 2号为NaOH溶液 |
正确的结论是( )
A. 4号为0.1mol/L盐酸 B.2号为0.1mol/LNaCl溶液
C. 3号为0.1mol/LNaOH溶液 D. 1号为1%酚酞
二、非选择题
26、(15分)科学家从化肥厂生产的![]() 中检出组成为
中检出组成为![]() 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以![]() 和
和![]() 两种离子形式存在,植物的根系极易吸收
两种离子形式存在,植物的根系极易吸收![]() ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)
A. 同种单质 B. 同位素 C. 同分异构体 D. 同素异形体
(2)![]() (填“能”或“不能”)和草木灰混合施用。
(填“能”或“不能”)和草木灰混合施用。
(3)已知白磷、![]() 的空间构型均为四面体,
的空间构型均为四面体,![]() 的结构式为
的结构式为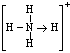 (
(![]() 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为![]() ,请画出
,请画出![]() 的结构式
。
的结构式
。
(4)已知液氨中存在着平衡![]() 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的![]() 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
。
生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
。
(5)含有一定量![]() 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时:![]() 加碱时:
加碱时:![]()
由于![]() 和
和![]() 的大量存在,加少量酸或碱时,溶液中C(H+)与C(OH—)基本保持不变;含有一定量
的大量存在,加少量酸或碱时,溶液中C(H+)与C(OH—)基本保持不变;含有一定量![]() 和
和![]() 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时 ;加碱时 。
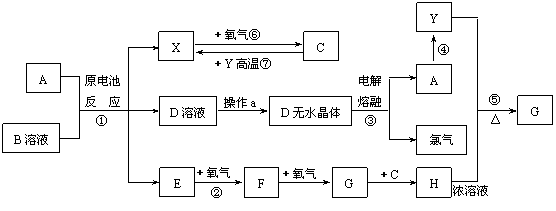 27.(15分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
27.(15分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
28.(15分)2005年全世界石油价格居高不下,其主要原因是随着社会生产的发展,人口增多,对能源的需求量逐年增加,全球石油储量下降。寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法。
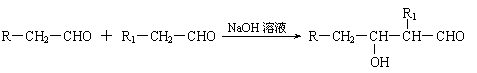 已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
⑵
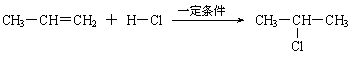 ⑶
⑶
合成路线如下:
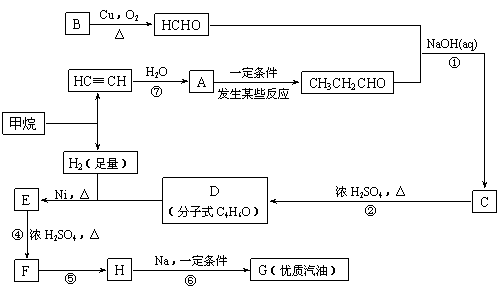
(1)写出D的结构简式
(2)在反应②~⑦中,属于加成反应的是 ,属于消去反应的是 。
(3)写出下列反应方程式
E → F: ;
H → G: 。
(4)H也能与NaOH溶液反应,其反应方程式为 ,生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化 (选填“能”或“否”)。
(5)化学工作者在对甲烷的发酵研究中,曾做过如下同位素示踪实验:
在同样反应条件下,请完成下列方程式:
① 。
② 。
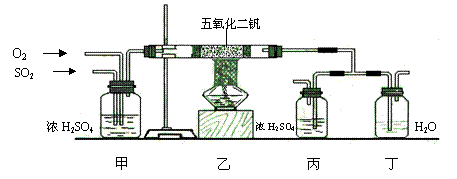 29.(1)工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内二硫化亚铁与氧气发生反应,生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气化合,生成三氧化硫; 三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,三氧化硫与水化合形成硫酸。为研究吸收SO3应选用的物质,仿照工业上制备硫酸的流程设计了下面的实验装置。
29.(1)工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内二硫化亚铁与氧气发生反应,生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气化合,生成三氧化硫; 三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,三氧化硫与水化合形成硫酸。为研究吸收SO3应选用的物质,仿照工业上制备硫酸的流程设计了下面的实验装置。
①根据上述设计,说明该实验的目的是 ;
写出在沸腾炉内发生反应的化学方程式 ;
②装置甲在本实验中的作用之一是 ;
③装置乙中,在催化剂作用下每生成1mol SO3气体放出98.3kJ热量,则该反应的热化学方程式为 ;
④反应中要求乙反应器内氧气的量要比二氧化硫的量多一倍左右,控制这一比例的实验现象是: ;
实验时发现,丁装置在反应过程中先出现气泡,不久就出现了白雾,而丙装置一直都没有任何现象。据此得出的下列结论中正确的是
A、浓硫酸不能吸收产生的气体 B、水与三氧化硫的反应是放热反应
C、浓硫酸吸收的效果比水好 D、水的吸收效果比浓硫酸好
⑤上述实验装置有合理的,也有不合理的。请就某一方面说说你对该实验装置的评价:
。
(2)某校研究性学习小组的同学对金属镁在空气中燃烧的产物进行探究。
①甲同学根据所学知识认为镁在空气中燃烧的产物就是氧化镁。请你用化学方程式表示甲的观点: ;
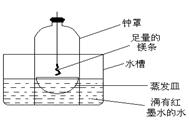 ②乙同学认为,空气中存在大量的氮气,镁也可能和氮气反应。他设计了如下装置进行实验:
②乙同学认为,空气中存在大量的氮气,镁也可能和氮气反应。他设计了如下装置进行实验:
镁条燃烧完后取出蒸发皿观察,发现蒸发皿中除有白色固体外还有少量的淡黄色固体。能支持乙同学观点的实验现象除生成淡黄色固体外还有 ,理由是 ;
③丙同学对乙同学实验中生成的淡黄色固体产生了兴趣,他向蒸发皿中的固体滴加少量水,发现有刺激性气味的气体产生,淡黄色固体转变成白色。请你写出上述过程中发生的化学反应方程式:
,
生成淡黄色固体的化学方程式是 ;
④丁同学通过查阅资料得知,Al4C3象淡黄色固体一样,遇水也能剧烈反应。请你写出Al4C3和水反应的化学方程式 。
6.C 7.C 8.C 9.C 10.D 11.A 12 B 13 D
26、(1)D(1分) (2)不能(1分)
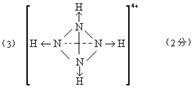
(4)![]() (2分)
(2分)
(5)![]() (2分)
(2分)
![]() (2分)
(2分)
27.(1)2Mg+CO2====2MgO+C
|
(3)4NH3+5O2====4NO+6H2O; (4)C+4HNO3====CO2↑+4NO2↑+2H2O
(5)2NH4++2e- = 2NH3↑+H2↑
28.(1)略(1分)(2)③⑤⑦(1分);②④(1分)
(3)(2分)
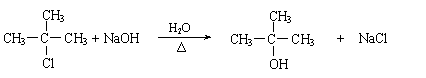 |
(4) (2分);否(1分)
(5)略(2分) 略(2分)
29. (1)① 比较浓硫酸和水吸收三氧化硫的效果 4FeS2 + 11O2 = 2Fe2O3 + 8SO2
② 净化二氧化硫和氧气,吸收水分。
![]() ③ 2SO2(g) +
O2 (g) 2SO3(g) △H=-196.6kJ/mol
③ 2SO2(g) +
O2 (g) 2SO3(g) △H=-196.6kJ/mol
④ 甲装置中,通SO2气体的导管口冒泡的速率大约是氧气导管口的2倍 ; B、C
⑤ 缺少尾气吸收装置等 合理答案均给分
(2)①2Mg+O2![]() 2MgO,2Mg+CO2
2MgO,2Mg+CO2![]() 2MgO+C
2MgO+C
②钟罩中的水面上升大大超过钟罩容积的1/5 空气中O2的体积分数约为1/5,CO2的体积分数很小,只有和N2反应钟罩中的水面上升才能大大超过钟罩容积的1/5
③Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
3Mg+N2![]() Mg3N2
Mg3N2
④Al4C3+12H2O=4Al(OH)3↓+3CH4↑