内蒙古包头市2006年高考第二次模拟考试
(理综)化学试题
相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 Fe .56 Cu .64 Ba .137
一.选择题
6.最近德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷的原子序数为37,下列关于铷的结构和性质的判断正确的是:
A.它在空气中燃烧只生成氧化铷 B.它的密度比钠小
C.它是强氧化剂 D.它与水反应比钠更剧烈
7下列指定微粒的数目之比等于1:1的是
A.CH3COOH溶液中的H+和 CH3COO-
B.Na2O2 晶体中的阳离子和阴离子
C.NaF溶液中的Na+ 和F-
D.1224Mg2+ 离子中的质子数和中子数
8.当反应HS-+ H2O ![]() H3O++S2- 已达平衡时,要使平衡向右移动,且 c (S2-) 有所增大,可加入
H3O++S2- 已达平衡时,要使平衡向右移动,且 c (S2-) 有所增大,可加入
A.少量胆矾 B. 水玻璃 C. 硫化钠溶液 D. 大量水
9. 下列有关实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀H2SO4中,铜片表面出现气泡
B.用铜片作阳极,铁片作阴极,电解氯化铜溶液,铁片表面出现一层铜
C.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴硫酸铜溶液,气泡放出速率加快
10.在恒温、恒容的密闭容器中进行反应A(g) ![]() B(g)+C(g),若A的浓度由2 mol·L-1降到0.8mol·L一1需要20s,那么A浓度再由0.8 mol·L-1降到0.2 mol·L-1所需要的时间为
B(g)+C(g),若A的浓度由2 mol·L-1降到0.8mol·L一1需要20s,那么A浓度再由0.8 mol·L-1降到0.2 mol·L-1所需要的时间为
A.lOs B.小于10s C.大于10s D.无法判断
11.下列各组晶体中,化学键类型完全相同,晶体类型也相同的是
A.CaCl2 CaC2 B.SO2 SiO2 C.NaCl HCl D.CO2 H2O
12.下列说法正确的是
A.不用其它试剂无法鉴别下列四种溶液: Na2CO3 、Al2(SO4)3 、NaCl、NaHSO4
B.实验室保存少量液溴和白磷常用水液封
C.在由水电离出的c(H+) =1×10-14 mol ·L—1 的溶液中可以大量存在 Na+ 、K+ 、NO3-、HCO3-离子
D.可以用分液漏斗分离下列三组液体混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇
13.在25℃时,V mL pH=a的盐酸中,滴加pH=b的NaOH溶液10V mL时,溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是
A、13 B、14 C、15 D、无法确定
26.(15分) 有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:
 |
请填写下列空格:
(1)戊分子的结构式是______________,
用电子式表示乙分子的形成过程__________________________________________。
(2)工业生产丙选择的条件是 .
(3)写出下列反应的化学方程式,并标出电子转移方向和数目
A+丙→D + 甲:_____________________________________________.
(4)若1.7 g 丙与O2反应生成气态的乙和丁时放出22.67 kJ热量,写出该反应的热化学方程式:___________________________________________________________________。
27.(15分) 27.(15分) 2005年诺贝尔化学奖授予了三位科学家,以表彰他们在烯烃复分解反应研究方面所取得的成绩。两种烯烃交换双键两端的基团,从而生成两种新的烯烃便是烯烃复分解反应。如:CH2=CHR1+CH2=CHR2![]() CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2
请回答下列问题:
(1)选择易于使用(常温常压下对空气稳定)的金属有机物为催化剂,CH3CH=CH2可以在温和条件下发生烯烃复分解反应。写出两个丙烯分子间发生烯烃复分解反应的化学方程式 。
(2).在(1)反应中的相对分子质量较大的产物经催化加氢后的一氯取代物有 种;
(3)丙烯在一定条件下可以发生反应生成聚丙烯.聚丙烯的结构简式是 , 反应类型是 反应.
(4)写出1-丙醇脱水生成丙烯的化学方程式并注明该反应的类型.
,反应类型是 反应..
如果1-丙醇中混有2-丙醇对反应产物有无影响?说明理由.
 .
.
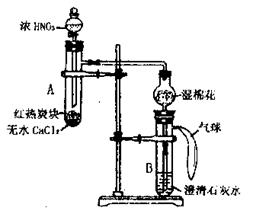
28. (16 分)下图所示是某校学生进行木炭与浓硝酸反应,并检验生成的气体和反应的热效应的实验装置,它具有无污染,现象明显的特点。具支试管A中所盛固体下层是无水CaCl2(做载体不参加反应),上层是红热的木炭。实验时慢慢将浓硝酸滴到木炭上,反应即开始进行且能长时间剧烈反应。
请回答下列问题:
(1)写出木炭与浓硝酸反应的化学方程式
__________________________________________
(2)试管上方的干燥管中放置一团湿棉花的作用是
(3)实验中具支试管A内出现的现象是_________________________________________
(4)试管B内出现的现象为
_______________________________________________,澄清石灰水中发生主要反应的离子方程式为 _______________;
(5)某学生在实验临近结束时,发现滴管中的浓硝酸难以滴下。若要再滴入几滴浓硝酸使木炭反应完全,最简单的办法是___________________________________
29.(14分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+ 、NH4+ 、 Mg2+ 、Fe3+、Cl-、CO32-、SO42-,现分为三等份,每次取100.mL溶液进行实验.
① 第一份加入 AgNO3 溶液有沉淀产生.
② 第二份加入足量NaOH溶液后加热,收集到气体0.896L(标准状况下)
③ 第三份加入足量BaCl2 溶液后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g.
试回答有关问题
(1) 原溶液中肯定存在的离子有
(2)请判断Cl-是否存在- (填下列序号)
A.一定存在 B. 可能存在 C.一定不存在
(3)肯定存在的离子在原溶液中的物质的量浓度分别是 .
.
内蒙古包头市2006年高考第二次模拟考试
(理综)化学试题参考答案
6 D 7 D 8 B 9 C 10 C 11 D 12 B 13 A
26.(15分).(1)H-O-Cl (2分) ![]() (3分)
(3分)
![]() (2)高温、高压、催化剂 (2分)
(2)高温、高压、催化剂 (2分)
(3) 3Cl2 + 2NH3== 6HCl+N2 (4分)
(4) 4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8 kJ·mol-1 (4分)
27 (15 分)
![]() (1)①2CH3CH=CH2 CH2=CH2
+ CH3 CH= CHCH3 (3分)
(1)①2CH3CH=CH2 CH2=CH2
+ CH3 CH= CHCH3 (3分)
②2 (3 分)
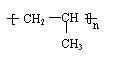 ③
(2分)
加聚 ( 1分)
③
(2分)
加聚 ( 1分)
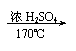 |
④CH3CH2CH2OH CH3CH=CH2 ↑+ H2O (3分) 消去(1分)
![]() 没有影响,因为异丙醇脱水也生成丙烯
(2 分)
没有影响,因为异丙醇脱水也生成丙烯
(2 分)
28.(16分 )(1)C+4HNO3 (浓) 4NO2↑+CO2↑+2 H2O (3分)
(2)吸收NO2 ,使其转变为NO,便于观察CO2与石灰水的反应(3 分)
(3)炭块保持红热,试管内有红棕色气体生成 (2 分)
(4)石灰水先变浑浊又变澄清;有气泡冒出,气体在试管上部空间变成浅红棕色.最后变为无色.(3分)
OH-+CO2=HCO3-;(2 分)
(5)使气球冷却降温。(其他合理答案也可)(3分)
29 .(14分)
(1) NH4+ 、 K+ 、 CO32- 、 SO42- (各1 分)
(2) B (2分)
(3) c (NH4+ )=0.4 mol ·L—1 (2 分) c (K+ )≥0.2 mol ·L—1 (2分)
c (CO32-)=0.2 mol ·L—1 (2分) c (SO42-)=0.1 mol ·L—1 (2分)
|
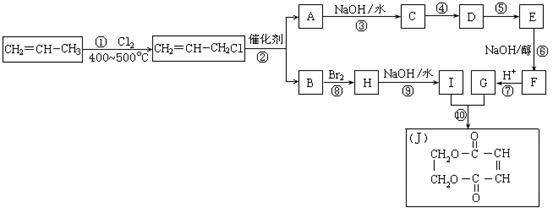
现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。反应④是与HCl加成,目的是保护A分子中C=C不被氧化.
 请按要求填空:
请按要求填空:
(1)A的结构简式是___________________________________________。
(2)化合物E含有的官能团是 。
(3)写出下列反应的反应类型:
①:______________,⑥:______________,⑧:______________。
(4)与G具有相同官能团的G的同分异构体的结构简式是 。
(5)反应⑩的化学方程式是___________________________________________。
27 (15 分)
. (1)ClCH2CH=CHCH2Cl (3分)
(2) 氯原子、羧基
(2分)
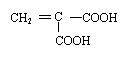 (3) 取代反应 消去反应 加成反应
(3分)
(3) 取代反应 消去反应 加成反应
(3分)
(4) (3分)
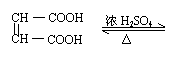 | |||
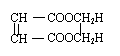 | |||
(5)HOCH2CH2OH. + +2 H2O (4分)