绵阳实验高中06级40天冲刺试题(化学4)
总分:108 时间:50分钟 命题人:zhouffww
6、设NA为阿佛加德罗常数,下列说法正确的是
A 1L 1mol/L的醋酸溶液中,所含分子数为NA B 1.8g重水(D2O)中含NA个中子
C 标况下的22.4L辛烷完全燃烧,生成CO2分子数为8NA
D 53g碳酸钠中含NA个CO32-
7、下列说法中正确的是
A 原子及其离子的核外电子层数等于该元素所在的周期数
B 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C 稀有气体原子的最外层电子数都是8 D 同主族金属的原子半径越大熔点越高
8、用0.1mol.L-1 NaOH溶液滴定0.lmol.L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL).继续加水至50mL,所得溶液的pH是
A 4 B 7.2 C 10 D 11.3
9、下列离子方程式书写正确的是
A 碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液
Ca2+ + 2HCO3- + 2OH- = CaCO3↓+ 2H2O + CO32-
B 用碳棒作电极电解氯化钠饱和溶液 2Cl—十H20=2OH-+Cl2↑+H2↑
C 硫化钠溶于水中溶液呈碱性 S2-+2H2O=H2S↑+2OH-
D 氯化亚铁溶液中加入硝酸 3Fe2+ + 4H+ + NO3— = 3Fe3+ + 2H2O + NO↑
10、新兴的大脑营养学研究发现,大脑的生长发育与不饱和脂肪酸有密切的关系,从深海鱼油中提取的,被称为“脑黄金”的DHA就是一种不饱和程度很高的脂肪酸,它的分子中含6个碳碳双键,学名二十六碳六烯酸,它的分子组成应是
A C25H50COOH B C25H39COOH C C26H41COOH D C26H40COOH
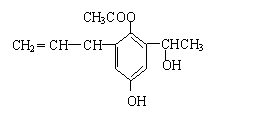 11、某有机物的结构简式如右图,则此有机物可发生的反应类型有:①取代 ②加成 ③消去
④酯化 ⑤水解 ⑥氧化 ⑦聚合 ⑧中和
11、某有机物的结构简式如右图,则此有机物可发生的反应类型有:①取代 ②加成 ③消去
④酯化 ⑤水解 ⑥氧化 ⑦聚合 ⑧中和
A ①②③④⑤⑥⑦⑧ B ②③④⑤⑥⑧
C ②③④⑤⑥⑦⑧ D ①②③⑤⑥
12、下列实验操作正确的是
A 用乙醇与浓硫酸制乙烯,为防止加热暴沸,应采取小火慢慢加热
B 在乙醛溶液中加入适量银氨溶液,再用酒精灯加热煮沸,观察银镜的生成
C 将溴乙烷与NaOH溶液混合煮沸,冷却,用HNO3酸化后再加入AgNO3,观察生成沉淀的颜色以检验溴乙烷中的Br
D 将乙醇、浓硫酸和冰醋酸的混合液水浴加热,将产生的蒸气导入饱和Na2CO3溶液收集乙酸乙酯
13、下列各组物质中,只用一种试剂就可以鉴别的有机物是
A C6H5OH、C6H6、CH3CHO、CCl4 B CH3CHO、C5H12、C2H5OH、CH3OH
C CH4、C2H2、C2H4、CH3CH=CH2 D 炭粉、MnO2、CuO、FeS
26、请按要求填空:
(1)下列实验操作或对实验事实的叙述正确的是__________________(填序号)
①用稀硝酸清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00 mL 0.1000 mol/L KMnO4溶液;
④用托盘天平称取10.50g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
 ⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
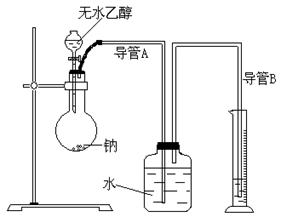
(2)为了确定乙醇分子的结构简式是
CH3―O―CH3还是CH3CH2OH,实验室利用右图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。试回答下列问题:
①指出实验装置的错误______ ___。
②若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得氢气的体积将______(填“偏大”、“偏小”或“不变”)。
③请指出能使实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)_____________ ___ 。
27、从电石开始,可以发生如下图所示的一系列变化:
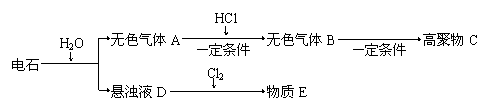 |
(1)写出电石与水反应的化学方程式 ;
(2)气体A为 分子,气体B为 分子。(填“极性”或“非极性”)
(3)写出生成高聚物C的化学方程式 ;
(4)实验室制得的气体A中常含有H2S、PH3等杂质,除杂所用试剂为 ;
(5)“D→E”是工业上生产漂白精的主要原理,请写出这一过程的离子方程式:
。
28、1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:
![]() RX+Mg
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RX+Mg
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
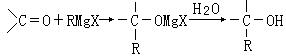
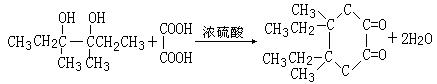
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:
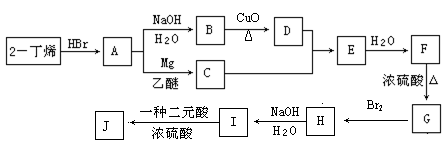 |
请按要求填空:
(1)3,4-二甲基-3-己醇是: (填代号),E的结构简式是 ;
(2)C+D→E的反应类型是 ,F→G的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
29、CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是
(2)已知在101kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是 。
(3)120℃、101kPa下,a mL由CO、CH4组成的混合气体在b mLO2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生bmL CO2,则混合气体中CH4的体积分数为
(保留2倍小数)。
②若燃烧后气体体积缩小了a/4mL,则a与b关系的数学表示式是 。
![]() 40天冲刺试题(化学4)
40天冲刺试题(化学4)
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
|
|
26、(1)
(2)① ;② ;
③ 。
27、(1)
(2) ;
(3)
(4) (5)
28、(1) ;
(2) ;
(3)
29、(1)
(2)
(3)① ②
参考答案
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| D | B | C | D | B | A | C | A |
26、(1)①②⑤⑧
(2)①广口瓶中导管长短倒置
②偏大
③检查装置气密性;钠块过量;无水乙醇需缓慢加入
27、(1)CaC2 + 2H2O → CH≡CH↑+ Ca(OH)2
(2)非极性;极性 (3)nCH2=CH-Cl→ [CH2-CH]n
(4)CuSO4溶液 (5)2Ca(OH)2+2Cl2=2Ca2++2Cl-+2ClO-+2H2O
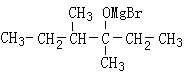 |
28、(10分)(1)F
(2)加成反应 消去反应
(3)CH3CH2CHBrCH3+NaOH![]() CH3CH2CH(OH)CH3+NaBr
CH3CH2CH(OH)CH3+NaBr
29、(1)1∶4
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H=-891kJ/mol
(3)①0.33 ②b≥5a/4