湖南省2006届高三 百校大联考 第一次考试
化 学 试 卷
总分110分 时量90分钟 2006年3月12日
|
|
醴陵一中;澧县一中;郴州二中;益阳市一中;桃源县一中
本卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分
可能用到的相对原子质量:
H:1 C:12 O:16 Na:23 Cl:35.5 K:39 Cr:52
Cu:64 Br:80 Ag:108 I:127 Ba:137
第I卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.下列化学名词正确的是
A.三溴笨酚 B.乙稀
C.乙酸乙脂 D.石炭酸
2.以下命题,违背化学变化规律的是
A.石墨制成金刚石 B.煤加氢变成人造石油
C.水变成汽油 D.电解法制氟气
3.某溶液中含有HCO3-、SO32-、SO42-、Cl-和Na+,若向其中通入Cl2后溶液中离子浓度增大的是
A.HCO3- B.SO42-
C.SO32- D.Na+
4.下列有关实验室一般事故的预防和处理方法正确的是
A.燃着的酒精灯打翻失火,应立即用水浇灭
B.少量酸或碱滴到实验台上,立即用湿抹布擦净,再用水冲洗抹布
C.金属钠着火时,可用干粉灭火器来扑灭
D.蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却
5.下列各组物质中,一定互为同分异构体的是
①淀粉和纤维素 ②蔗糖和麦芽糖 ③乙醇和乙醚 ④丙烷和环丙烷 ⑤硝基乙烷和氨基乙酸 ⑥氰酸铵(NH4CNO)和尿素
A、①③④ B、②⑤⑥
C、②③⑤ D、全不是
6.下列有关比较中,大小顺序排列错误的是
A.热稳定性:PH3>H2S>HBr>NH3
B.物质的熔点:石英>食盐>冰>汞
C.结合H+的能力:CO32->CH3COO->SO42-
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
7.设NA为阿伏加德罗常数,下列说法正确的是( )
A.金属钠与水反应,失去NA个电子
B.标准状况下,aLCH4和aLC6H14中所含分子数均为aNA/22.4
C.常温常压下,1mol氯气与足量金属镁反应,转移2NA个电子
D.在20℃,1.01×105Pa时,2.8gC2H4和CO的混合气体,含气体分子数小于0.1NA
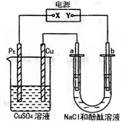
|
A.x是正极,y是负极,CuSO4溶液的pH逐渐减小
B.x是正极,y是负极,CuSO4溶液的pH保持不变
C.x是负极,y是正极,CuSO4溶液的pH 逐渐减小
D.x是负极,y是正极,CuSO4溶液的pH保持不变
9.下列离子方程式正确的是
A.明矾溶液中加入过量的氨水 Al3++4OH-== AlO2-+2H2O
B.漂白粉溶液中通入过量的二氧化碳Ca2++2ClO-+CO2+H2O==CaCO3↓+2HClO+CO32-
C.FeBr2溶液中加入过量的氯水 2Br-+Cl2==Br2+2Cl-
D.澄清的石灰水中加入过量的NaHCO3溶液 Ca2++2OH-+2HCO3-==CaCO3↓+2H2O+CO32-
10.已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则
乙炔燃烧的热化学方程式正确的是
A.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -4b KJ/mol
B.C2H2(g) + 5/2O2(g) == 2CO2(g) + H2O(l);△H = 2b KJ/mol
C.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -2b KJ/mol
D.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = b KJ/mol
11.某温度下,在一容积可变的容器中,反应2A(g)+B(g) ![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,在保持温度不变的条件时下列操作不会使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,在保持温度不变的条件时下列操作不会使平衡右移的是
A.压强不变时,A、B和C均增加lmol
B.压强不变时,充入少量不参与反应的氖气
C.容积不变时,A、B和C均增加1mol
D.容积不变时,充入物质的量之比为2∶1的A和B
12.在右下图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是
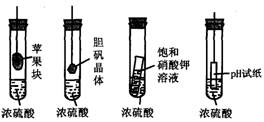
A.苹果块会干瘪 B.胆矾晶体表面有“白斑”
C.小试管内有晶体析出 D.pH试纸变红
13.将含有O2和CH4的混合气体置于盛有23.4 g Na2O2的密闭容器中,电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中,无气体产生。下列叙述正确的是
A.原混合气体中O2和CH4的体积比为2∶1 B.残留物只有Na2CO3
C.原混合气体中O2与CH4的体积比为1∶1 D.残留物只有Na2CO3和NaOH
14.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
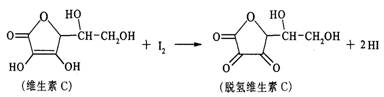
下列说法正确的是
A.上述反应为取代反应 B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶 D.维生素C的分子式为C6H7O6
15.某二元酸(化学式用H2A表示)在水中的电离方程式是: H2A == H++HA-,
HA-![]() H++A2-;则在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式不合理的是
H++A2-;则在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式不合理的是
A.c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1 B.c(OH-)=c(H+) +c( HA-)
C.c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-) D.c(Na+ )= 2c(A2-) +2c( HA-)
16.将KCl和CrCl3两种固体混合物共熔发生化合反应制得化合物X。将1.892gX中Cr元素全部氧化成Cr2O72-, Cr2O72-可与过量的KI发生氧化还原反应氧化出2.667g I2,反应的离子方程式是:Cr2O72-+6I-+14H+=2Cr3++3 I2+7H2O,如果取溶有1.892g X的溶液,加入过量的AgNO3,可得4.52gAgCl沉淀,则表示X组成的化学式为
A.K3Cr2Cl7 B.K3Cr2Cl5
C.K3Cr2Cl9 D.K2CrCl4
第II卷(非选择题,共62分)
二、(本大题包括两个小题,共22分)
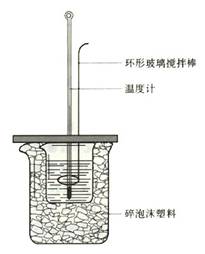 17.(10分)实验室用50 mL 1.0 mol·L-1盐酸跟50
mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放
17.(10分)实验室用50 mL 1.0 mol·L-1盐酸跟50
mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放
出的热量来计算中和热。试回答下列问题:
⑴大小烧杯间填满碎泡沫塑料的作用是 。
⑵ (填“能”或“不能”)将环形玻璃搅拌棒
改为环形金属(如铜)棒。其原因是 。
⑶大烧杯上如不盖硬纸板,对求得中和热数值的影响
是 (填“偏高”或“偏低”或“无影响”)。
⑷如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1
氢氧化钠溶液进行反应,则与上述实验相比,所放热量
(“增加”、 “减少”或“不变”),理由是
;
所求中和热数值 (“增加”、 “减少”或“不变”),
理由是 。
18.(12分)已知胆矾在不同温度下可以逐步失水:
CuSO4·5H2O——→CuSO4·3H2O——→CuSO4·H2O——→CuSO4
某课外活动小组准备用浓硫酸和铜片为主要原料制取少量胆矾,其主要步骤有:①取少量铜片放在干燥的蒸发皿内,用酒精灯灼烧到其表面变黑为止;②向蒸发皿内加入一定量浓硫酸并加热,反应结束后发现有少量黑色固体及白色固体存在;③将上述冷却后的反应混合物用水稀释得蓝色溶液,白色固体消失,但仍有黑色固体存在;④向稀释后的所得溶液中加入过量碱式碳酸铜[Cu2(OH)2CO3],充分搅拌;⑤过滤,弃去不溶物;⑥将滤液转回洗净的蒸发皿内,用沸水浴缓缓加热蒸发,浓缩至表面有晶膜析出时为止,取下蒸发皿使溶液冷却,析出蓝色晶体。
⑴步骤⑤中要用到的玻璃仪器有 。
⑵步骤④中发生反应的离子方程式是 。
⑶简述步骤③的具体操作方法
。
⑷下列叙述错误的是 (有错选得“0”分)
A、将铜片灼烧,可以减少浓硫酸的消耗量。
B、用浓硫酸溶解灼烧后的铜片时,应在通风橱中进行。
C、步骤②中得到的黑色固体是CuO。
D、步骤②中得到的白色固体是CuSO4。
E、步骤⑥中为加快蒸发速度,也可用酒精灯直接给蒸发皿加热。
三、(本题包括3个小题,共30分)
19.(12分)NH4NO3在不同条件(温度)下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应
⑴若NH4NO3在通常条件下加热的分解产物不出下列范围,根据已学知识(化合价升降规律等)判断,下列反应可能的是 (有错选得“0”分)
A、NH4NO3→N2+O2+H2O B、NH4NO3→NH3+HNO3
C、NH4NO3→O2+HNO3+H2O D、NH4NO3→N2+HNO3+H2O
E、NH4NO3→N2+NH3+H2O F、NH4NO3→N2O+H2O
⑵现将NH4NO3晶体在三种不同温度下加热使其分解,若分解产物能发生如图所示的转化关系(仅反应条件及反应Ⅱ、Ⅲ两个反应中生成的水被略去)
回答下列问题
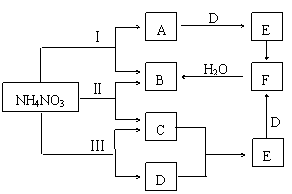 |
①写出下列物质的分子式
A、 E、 F、
②请写出反应Ⅲ的化学方程式
Ⅲ、
 20.(10分)甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:
20.(10分)甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:
甲 丁
若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙。回答下列问题:
⑴乙的分子结构中一定含有的官能团是 (填名称);丙的分子结构中一定含有的官能团的电子式为 。
⑵乙、丙的相对分子质量之差为 (填一个数字)的整数倍。
⑶满足上述转化关系的甲、乙、丙、丁中,相对分子质量最小的甲的结构简式为 ,此时,生成丁的化学方程式为 。
21. (8分)现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素,已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超出它们。根据以上信息回答下列有关问题:
⑴请判断B2A4、C2A4、E2A4三种化合物中沸点最高的是 。
⑵从题中元素为选择对象组成物质,写出三个由两种元素组成且每个分子中有18个电子的物质的分子式 。
⑶从题中元素为选择对象组成物质,写出三种可用作炸药的物质的化学式或名称:
。
⑷从给定的元素中选出若干种组成化合物,写出相对分子质量最小的离子化合物的化学式 。
四、(本题包括1个小题,共10分)
22.(10分) 不同卤素原子间可以通过共用电子对,形成卤素互化物,其通式为:XX′n (n = 1,3,5,7;且非金属性X′>X)。卤素互化物大多为强氧化剂。回答下列问题:
⑴卤素互化物中,沸点最低的应是 (写分子式,下同)。
⑵若n = 7,则最可能生成的卤素互化物应为 。
⑶某卤素互化物与水的反应为 ClFn + H2O → HClO3 + Cl2 +O2 + HF,若ClFn与H2O的物质的量之比为3∶5,求n的值。
⑷现将23.3gBrCln溶于水,再通入过量SO2,生成HBr、HCl、H2SO4等三种酸,然后向该混合酸溶液中加入过量Ba(NO3)2溶液后,过滤,最后向滤液中加入过量的硝酸银溶液,结果可生成77.3g沉淀,求n的值。
![]() 湖南省2006届高三 百校大联考 第一次考试
湖南省2006届高三 百校大联考 第一次考试
 化学试题答题卡
化学试题答题卡
(考试时间:90分钟;满分:110)
姓 名 本次不填
 |
![]() 准考证号
准考证号
![]()
 |

一.选择题(每题只有一个正确选项 每题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | ||||
| 答案 |
|
| ||||

|

湖南省2006届高三百校大联考第一次考试
化 学 参考答案及评分标准
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | B | B | B | A | C | A | D | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | ||||
| 答案 | B | D | D | B | A | C |
17. ⑴减少实验过程中的热量损失(1分)
⑵不能(1分) ; 因金属易导热(1分)
⑶偏低(1分)
⑷增加(1分);后者生成0.055mol的H2O,而前者只能生成0.050mol的H2O(2分);
不变(1分);“中和热”是指酸跟碱发生中和反应生成1摩尔H2O时所放出的热量,与酸碱的用量无关 (2分)
18. ⑴漏斗、烧杯、玻璃棒 (3分,少一个扣1分,全部写对但多了不需要的玻璃仪器只得2分,三种未写全又多了不需要的玻璃仪器得0分,其它仪器多了不扣分)
⑵ Cu2(OH)2CO3 + 4H+ == 2Cu2+ + CO2↑+ 3H2O (3分)
⑶将反应混合物沿烧杯内壁倒入盛有适量水的烧杯中(2分),并用玻璃棒不断搅拌(1分)
⑷C、E(3分,只选对其中一个得1分,有错选得0分)
19. ⑴A、B、D、F(4分,每选对一个得1分,有错选得0分)
|
②Ⅲ 2NH4NO3 == 2N2 + O2 + 4H2O(2分,未写加热符号可不扣分)
|
20. ⑴羧基(2分,有错别字不得分) ·O∶H(2分)
|
⑶HCHO(2分) HCOOH + CH3OH
![]() HCOOCH3
+ H2O(2分,写→不扣分,未写反应条件不计分)
HCOOCH3
+ H2O(2分,写→不扣分,未写反应条件不计分)
21. ⑴N2H4(2分)
⑵C2H6 、N2H4、H2O2 、PH3(2分,任答三种得2分,少一个扣1分,不出现负分;全部写对但多了错误的只得2分,三个未写全又多了错误的得0分)
⑶硝酸铵、TNT、硝化甘油、火棉等 (2分,任答三种得2分,少一个扣1分,不出现负分;全部写对但多了错误的只得2分,三个未写全又多了错误的得0分)
⑷HCOONH4(2分,写出NH4H也给2分)
22. ⑴ClF(2分)
⑵IF7(2分)
⑶n = 3(过程正确,结果正确3分;过程错误,结果正确1分;过程正确,结果错误1分)
解题过程提示
由ClFn与H2O的物质的量之比为3∶5可得下列配平的方程式
3ClFn + 5H2O → (10-3n)HClO3 + (3n-7)Cl2 +(9n-25)O2 + 3nHF
所以有:
10-3n>0
3n-7>0
![]() 9n-25>0
9n-25>0
⑷n = 3(过程正确,结果正确3分;过程错误,结果正确1分;过程正确,结果错误1分)
解题过程提示
设BrCln有xmol 则
![]() (80+35.5n)x =
23.3
(80+35.5n)x =
23.3
(188+143.5n)x= 77.3
两式相除得![]()
用合分比定理化简得
![]()